1. ņä£ ļĪĀ
ĒؼĒåĀļźśļŖö ļÅģĒŖ╣ĒĢ£ Ļ┤æĒÖöĒĢÖņĀü, ņĀäņ×ÉĻĖ░ņĀü ņä▒ņ¦łņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤ ĒśĢĻ┤æņ▓┤, ņ×Éņä▒ņ×¼ļŻī, ņłśņåīņĀĆņןĒĢ®ĻĖł, ņ┤ēļ¦ż ļō▒ ņ▓©ļŗ© ĒĢĄņŗ¼ ņåīņ×¼ņØś ĒĢäņłś ņøÉļŻīļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ĻĘĖ ņżæņŚÉņä£ļÅä ĒŖ╣Ē׳ ļäżņśżļööļ«┤ņØĆ ĒĢ®ĻĖł ņżæ ņ▓©Ļ░ĆņĀ£ļĪ£ņä£ļ┐É ņĢäļŗłļØ╝ ņ×ÉļÅÖņ░©, ĻĄ░ņé¼ņןļ╣ä, ņØśļŻīĻĖ░ĻĖ░ ļō▒ Ļ░üņóģ ņ▓©ļŗ© ĻĖ░ĻĖ░ņØś ņĀäĻĖ░ņĀäņ×É ļČĆĒÆłņŚÉ ņé¼ņÜ®ļÉśļŖö Nd-Fe-B ņśüĻĄ¼ņ×ÉņäØņØś ņøÉļŻīļĪ£ņä£ [1], ĒؼĒåĀļźś ņøÉņåī ņżæ ņŗ£ņן ĻĘ£ļ¬©Ļ░Ć Ļ░Ćņן Ēü¼ļ®░ ņłśņÜöļ¤ēņØ┤ ĻĖēņ”ØĒĢśĻ│Ā ņ׳ļŗż [2-4].
ņżæĻ░ä ņøÉļŻī ņåīņ×¼ņØĖ ļäżņśżļööļ«┤ ĻĖłņåŹ(ņØ┤ĒĢś Nd ĻĖłņåŹ)ņØä ļ╣äļĪ»ĒĢ£ ĒؼĒåĀļźś ĻĖłņåŹņØś ņŻ╝ņÜö ņĀ£ņĪ░ĻĖ░ņłĀļĪ£ ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ļ▓ĢĻ│╝ ĻĖłņåŹ ņŚ┤ĒÖśņøÉļ▓ĢņØä ļōż ņłś ņ׳ņ£╝ļ®░, ņØ┤ļōżļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒؼĒåĀļźś ĻĖłņåŹņØś Ļ│Āņł£ļÅäĒÖöļź╝ ņ£äĒĢ┤ ņ¦äĻ│Ąņ”Øļźśļ▓ĢņØ┤ ĒÖ£ņÜ®ļÉĀ ņłś ņ׳ļŗż [5,6]. ĻĘĖļ¤¼ļéś ņØ╝ļČĆ ļ╣äņĀÉņØ┤ ļé«ņØĆ Sm, Eu, Tm, Yb ļō▒Ļ│╝ ņåīļ¤ēņØś Ļ│Āņł£ļÅä ĒؼĒåĀļźś ĻĖłņåŹņØä ņĀ£ņĪ░ĒĢśļŖö Ļ▓ĮņÜ░ ņÖĖņŚÉļŖö ļīĆļČĆļČäņØś ĒؼĒåĀļźś ĻĖłņåŹņØ┤ ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ļ▓Ģņ£╝ļĪ£ ņĀ£ņĪ░ļÉśĻ│Ā ņ׳ļŗż [5-7]. ĒؼĒåĀļźś ĻĖłņåŹņØś ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ļŖö ņŚ╝ĒÖöļ¼╝ ņĀäĒĢ┤(ņŚ╝ĒÖöļ¼╝ ņÜ®ņ£ĄņŚ╝Ļ│ä ĒؼĒåĀļźś ņŚ╝ĒÖöļ¼╝ ņĀäĒĢ┤)ņÖĆ ņé░ĒÖöļ¼╝ ņĀäĒĢ┤(ļČłĒÖöļ¼╝ ņÜ®ņ£ĄņŚ╝Ļ│ä ĒؼĒåĀļźś ņé░ĒÖöļ¼╝ ņĀäĒĢ┤)ļĪ£ ļīĆļ│äļÉ£ļŗż [8]. ņŚ╝ĒÖöļ¼╝ ņĀäĒĢ┤ļŖö ĒؼĒåĀļźś ņŚ╝ĒÖöļ¼╝ņØś ļČäĒĢ┤ņĀäņĢĢņØ┤ ņĀüņĀłĒĢśĻ│Ā ņĪ░ņ×æņś©ļÅäĻ░Ć ļé«ņĢä ņĀĆņ£ĄņĀÉņØś ĒؼĒåĀļźś ĻĖłņåŹņŚÉ ņ£Āļ”¼ĒĢ£ ņןņĀÉņØä Ļ░¢Ļ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņŚ╝ņØś Ē£śļ░£ņä▒Ļ│╝ ņÜ®ņ£Ą ņŚ╝ĒÖöļ¼╝ ļé┤ ĒؼĒåĀļźś ĻĖłņåŹņØś ņÜ®ĒĢ┤ļÅäĻ░Ć Ēü¼Ļ│Ā, ņĀäļźś ĒÜ©ņ£©Ļ│╝ ĻĖłņåŹ ņłśņ£©ņØ┤ ļé«ņØä ļ┐É ņĢäļŗłļØ╝, ņŚ╝ĒÖöļ¼╝ ņøÉļŻīņØś ĒØĪņŖĄņä▒, ļÅģņä▒ņØś ņŚ╝ņåīĻ░ĆņŖż ļ░£ņāØ ļō▒ņØś ļŗ©ņĀÉņØ┤ ņ׳ļŗż [7-9]. ļö░ļØ╝ņä£ 1980ļģäļīĆ ņØ╝ļ│ĖņŚÉņä£ Nd ņśüĻĄ¼ņ×ÉņäØņØ┤ Ļ░£ļ░£ļÉśļ®┤ņä£ Nd ĻĖłņåŹņØś ņłśņÜöĻ░Ć ņ”ØĻ░ĆļÉśņ×É ņŚ╝ĒÖöļ¼╝ ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ļĪ£ļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ļŖö Nd ĻĖłņåŹņØś ņĀ£ņĪ░ļź╝ ņ£äĒĢ┤ ņé░ĒÖöļ¼╝ ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ļ▓ĢņØ┤ ļ│ĖĻ▓® Ļ░£ļ░£ļÉśņŚłļŗż [5,9]. ņé¼ņŗż, Nd ĻĖłņåŹņØ┤ ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ņŚÉ ņØśĒĢ┤ ĒĢ┤ņÖĖ, ĒŖ╣Ē׳ ņżæĻĄŁņŚÉņä£ ņāüņÜ® ņāØņé░ļÉśĻ│Ā ņ׳ņØīņØĆ ņל ņĢīļĀżņĀĖ ņ׳ļŗż. ĻĘĖļ¤¼ļéś Nd ĻĖłņåŹņØś ņĀ£ņĪ░ņŚÉļŖö ļ¦ÄņØĆ ļ│ĆņłśĻ░Ć ņśüĒ¢źņØä ļ»Ėņ╣śļŖöļŹ░ ļ░śĒĢ┤ ņØ┤ņŚÉ ļīĆĒĢ£ ĻĖ░ņłĀņĀü ļ│┤Ļ│Ā ņ×ÉļŻīļŖö Ļ▓░Ļ│╝ ņ£äņŻ╝ļĪ£ ļ¦żņÜ░ ņĀ£ĒĢ£ņĀüņØ┤Ļ▒░ļéś ļŗ©ĒÄĖņĀüņØ┤ļØ╝ļŖö ņĀÉļÅä ņŻ╝ņ¦ĆņØś ņé¼ņŗżņØ┤ļŗż.
ļö░ļØ╝ņä£ ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ĒؼĒåĀļźś ņøÉņåī ņżæ Ļ░Ćņן ņżæņÜöĒĢ£ ņ£äņ╣śļź╝ ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳ļŖö Nd ĻĖłņåŹņØś ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ ņĀ£ņĪ░ņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż. ĒŖ╣Ē׳ FLiNdBa ņÜ®ņ£ĄņŚ╝ ļé┤ Nd ņé░ĒÖöļ¼╝ ņĀäĒĢ┤ņŚÉ ņØśĒĢ£ Nd ĻĖłņåŹ ņĀ£ņĪ░ņŚÉ ļīĆĒĢ┤ ņŗżĒŚś Ļ▓░Ļ│╝ļ┐É ņĢäļŗłļØ╝ Ļ│╝ņĀĢĻ│╝ ļ░®ļ▓ĢņØä ļ╣äĻĄÉņĀü ņ×ÉņäĖĒ׳ ņä£ņłĀĒĢ©ņ£╝ļĪ£ņŹ© ņĀäĒĢ┤ ņ×æņŚģņØś ļŗ©ĒÄĖņĀü ņĀĢļ│┤ ņĀ£Ļ│Ą ļīĆņŗĀņŚÉ ņŗżĒŚśĻ│╝ Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ņóģĒĢ®ņĀü ņØ┤ĒĢ┤ņÖĆ ņ×¼Ēśäņä▒ņØä ļÅĢĻ│Āņ×É ĒĢśņśĆļŗż.
2. ņŗżĒŚś ļ░®ļ▓Ģ
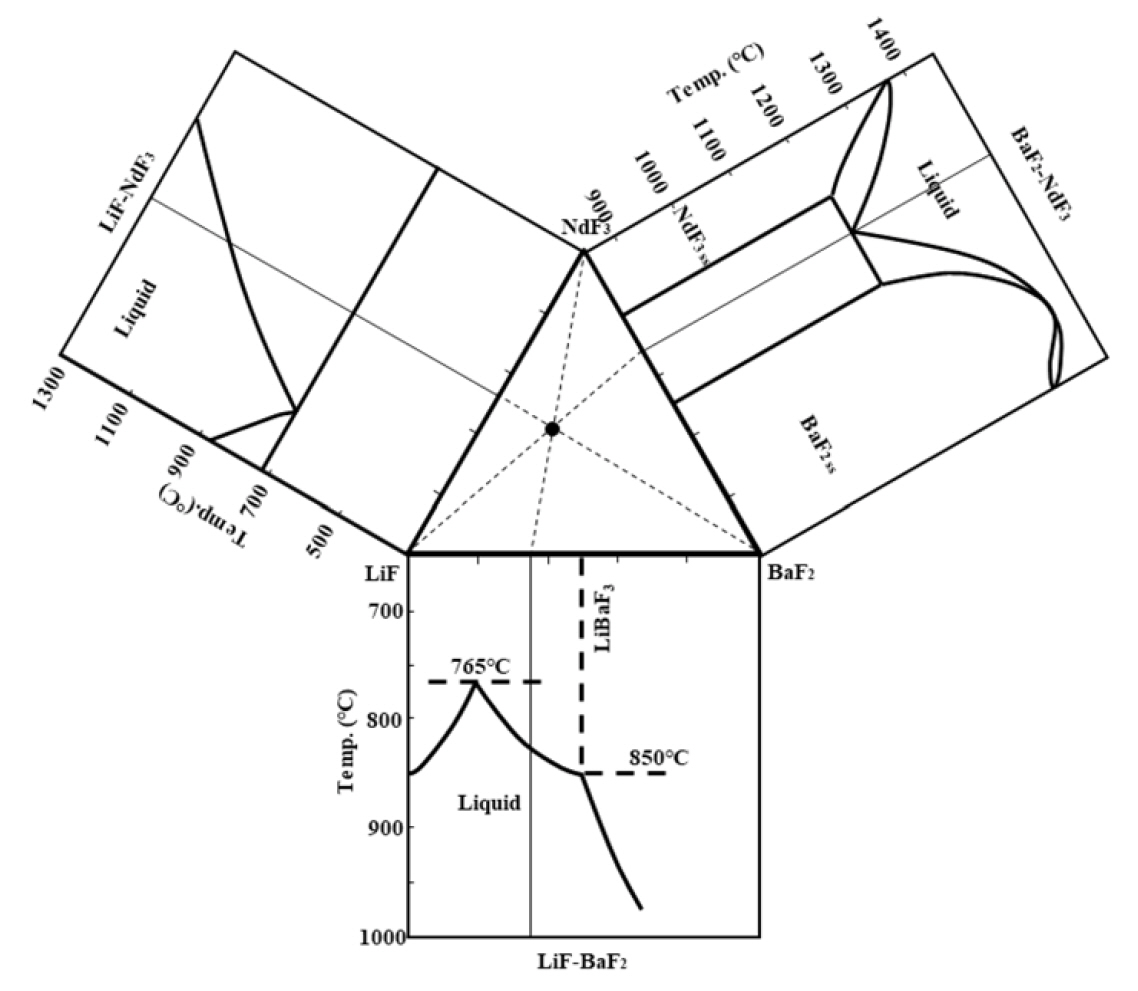
2.1 ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņĪ░ņä▒
Nd2O3ļŖö ņ£ĄņĀÉņØ┤ ļåÆņĢä ļŗ©ļÅģņ£╝ļĪ£ ņÜ®ĒĢ┤, ņĀäĒĢ┤Ļ░Ć Ļ│żļ×ĆĒĢśļ»ĆļĪ£ IņĪ▒ ļśÉļŖö IIņĪ▒(ņĢīņ╣╝ļ”¼ ļśÉļŖö ņĢīņ╣╝ļ”¼ĒåĀļźś) ĻĖłņåŹņØś ļČłĒÖöļ¼╝Ļ│╝ NdF3ņØś Ēś╝ĒĢ® ņÜ®ņ£Ąņ▓┤(ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝)ļĪ£ ņÜ®ĒĢ┤ Ēøä ņĀäĒĢ┤ ĒÖśņøÉĒĢ£ļŗż. ĻĘĖ ņśłļŖö LiF-NdF3 [9-11], LiF-NdF3-BaF2 [12], LiF-NdF3-CaF2 [13] ļō▒ ļ╣äĻĄÉņĀü ļŗżņ¢æĒĢśļ®░ Nd-oxyfluorideļź╝ ĒśĢņä▒ĒĢśļ®┤ņä£ ļ│┤ļŗż ņēĮĻ▓ī ņÜ®ĒĢ┤ļÉśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņäżļ¬ģļÉśĻ│Ā ņ׳ļŗż [11,13]. ĒĢ£ĒÄĖ, ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņĪ░ņä▒ņØĆ ĻĘĖĻ▓āņØś ņ£ĄņĀÉ, ĒÖśņøÉņĀäņ£ä, ņ”ØĻĖ░ņĢĢ, Nd2O3ņØś ņÜ®ĒĢ┤ļÅä, ņ£ĀļÅÖņä▒ ļō▒ņŚÉ Ļ┤ĆļĀ©ļÉśļ»ĆļĪ£ ņĀäĒĢ┤ņś©ļÅä, ņØĖĻ░Ć ņĀäļźś┬ĘņĀäņĢĢņØś ņäĖĻĖ░, Nd2O3ņØś Ēł¼ņ×ģ ņåŹļÅä ļō▒Ļ│╝ ļŹöļČłņ¢┤ ņĀäĒĢ┤ ĒÖśņøÉņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņŻ╝ņÜö ņØĖņ×É ņżæ ĒĢśļéśņØ┤ļŗż. ĻĘĖļ¤¼ļéś Ļ│ĄĻ░£ļÉśņ¦Ć ņĢŖĻ▒░ļéś ņĀ£ĒĢ£ļÉ£ ņĪ░ņä▒ņŚÉ ļīĆĒĢ┤ņä£ļ¦ī ļ│┤Ļ│ĀĻ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖ Ļ░£ņäĀņØś ņŚ¼ņ¦ĆĻ░Ć ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö LiF-NdF3-BaF2 Ļ│äļź╝ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņ£╝ļĪ£ ņØ┤ņÜ®ĒĢśļÉś ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņØ┤ņ£ĀļĪ£ ĻĘĖ ņĪ░ņä▒ņØä Ļ▓░ņĀĢĒĢśņśĆļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĒؼĒåĀņé░ĒÖöļ¼╝ņØś ļČłĒÖöļ¼╝ ļé┤ ņÜ®ĒĢ┤ļÅäļŖö ņĢīņ╣╝ļ”¼ ļśÉļŖö ņĢīņ╣╝ļ”¼ĒåĀļźśĻĖłņåŹņØś ļČłĒÖöļ¼╝ņŚÉņä£ļ│┤ļŗż ņ×Éņ▓┤ ĒؼĒåĀļČłĒÖöļ¼╝ņŚÉņä£ ļŹö Ēü¼ļŗż. ĻĘĖļ¤╝ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā Nd2O3ņØś Ļ▓ĮņÜ░ LiF-NdF3 2ņøÉĻ│ä ļé┤ NdF3Ļ░Ć richĒĢ£ ņśüņŚŁ(NdF3= 74~90 wt%)ņŚÉņä£ ņĪ░ņ░© ņÜ®ĒĢ┤ļÅäĻ░Ć ņĢĮ 2 wt%ņŚÉ ļČłĻ│╝ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż [14]. ļö░ļØ╝ņä£ NdF3ņÖĆ LiFņØś ļ¼┤Ļ▓īļ╣äļŖö 9:1ļĪ£ ĒĢśĻ│Ā NdF3ņÖĆ BaF2ņØś ļ╣äļŖö ņ£ĄņĀÉņØä ļé«ņČ£ ņłś ņ׳ļÅäļĪØ BaF2-NdF3 ņāüĒā£ļÅä [15]ņŚÉņä£ Ļ│ĄņĀĢ ņĪ░ņä▒ļ╣äĻ░Ć ļÉśļÅäļĪØ ĒĢśņśĆļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ņĀĢĒĢ┤ņ¦ä ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņĪ░ņä▒ņØä mol%ļĪ£ ļéśĒāĆļéĖ ĻĘĖļ”╝ 1ņŚÉ Ēæ£ņŗ£ĒĢśņśĆņ£╝ļ®░ ņØ┤ļŖö ļ¼┤Ļ▓īļ╣äļĪ£ LiF:NdF3:BaF2 = 7.5:67.4:25.1 ņØ┤ļŗż.
2.2 ņøÉļŻī ļ░Å ņŗżĒŚś ņןņ╣ś
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ļÉ£ ņøÉļŻīļōżņØś ņĀ£ņĪ░ņé¼ņÖĆ ņł£ļÅäļŖö ņØ┤ĒĢśņÖĆ Ļ░Öļŗż. BaF2ļŖö ŌĆ£Alfa AesarŌĆØ ņĀ£ĒÆłņ£╝ļĪ£ ņł£ļÅä 98.5% ņØ┤ņāüņØ┤ņŚłņ£╝ļ®░, LiF, NdF3 ļ░Å Nd2O3ļŖö ŌĆ£China Rare Metal Material Co., ltdŌĆØ ņĀ£ĒÆłņ£╝ļĪ£ Ļ░üĻ░ü ņł£ļÅä 99.5%, 99.5%, 99.9% ņØ┤ņāüņØ┤ņŚłļŗż.
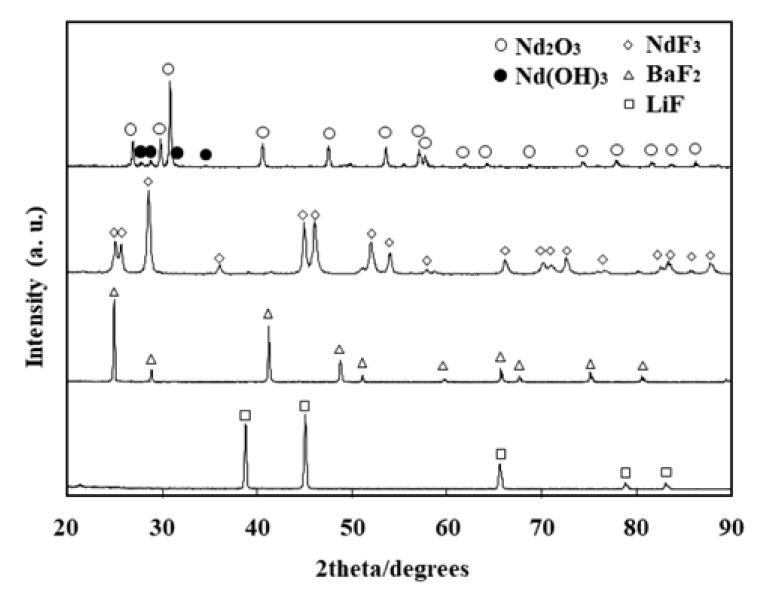
ĻĘĖļ”╝ 2ļŖö ņØ┤ļōż ņøÉļŻīļōżņØś XRD Ēī©Ēä┤ņØä ļ│┤ņŚ¼ņżĆļŗż. ĻĘĖļ”╝ 2ņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ĻĄ¼ņä▒ ņä▒ļČäņØĖ ļČłĒÖöļ¼╝ļōżņØĆ ļ¬©ļæÉ ļŗ©ņØ╝ ņāüņ×äņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ņ£╝ļéś ĒÖśņøÉ ņøÉļŻīņØĖ Nd2O3ļŖö ņåīļ¤ēņØś Nd(OH)3 ņāüņØ┤ Ļ│ĄņĪ┤ĒĢśĻ│Ā ņ׳ņØīņØä ļéśĒāĆļé┤Ļ│Ā ņ׳ļŗż.
Nd(OH)3ļŖö ņĢĮ 430~650 ┬░C ļ▓öņ£äņŚÉņä£ ĒĢśņåīņŚÉ ņØśĒĢ┤ 2Nd(OH)3= Nd2O3 + 3H2O ļ░śņØæņ£╝ļĪ£ ļČäĒĢ┤ļÉ£ļŗż [16,17]. ņ┤łĻĖ░ņŚÉ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝Ļ│╝ ĒĢ©Ļ╗ś Ēł¼ņ×ģļÉśļŖö Nd2O3 ņżæņØś Nd(OH)3ļŖö ņĀäĒĢ┤ņś©ļÅäĻ╣īņ¦Ć ņŖ╣ņś© ņżæņŚÉ ļČäĒĢ┤ ņĀ£Ļ▒░ļÉĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļéś ņĀäĒĢ┤ ņżæ ņČöĻ░Ć Ēł¼ņ×ģļÉśļŖö Nd2O3 ņżæņØś Nd(OH)3ļŖö ņāüĻĖ░ ļČäĒĢ┤ ļ░śņØæņŚÉ ņØśĒĢ┤ ņĀäĒĢ┤ Ļ│ĄņĀĢņØä ĻĄÉļ×ĆĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņŚłļŗż. ļö░ļØ╝ņä£ Nd2O3ņØś ĒØĪņŖĄĻ│╝ Nd(OH)3ņØś ņāØņä▒ņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ Nd2O3ļź╝ ĻĖĆļĪ£ļĖī ļ░ĢņŖżņŚÉ ļ│┤Ļ┤ĆĒĢśļ®┤ņä£ ĒĢäņÜö ņŗ£ Ļ║╝ļé┤ņ¢┤ ņé¼ņÜ®ĒĢśņśĆļŗż. ĒÖśņøÉ ņøÉļŻī Nd2O3ņØś Ēł¼ņ×ģņŚÉ ļīĆĒĢ┤ņä£ļŖö ĒøäņłĀĒĢśļŖö ņŗżĒŚśļČĆļČäņŚÉņä£ ņ×ÉņäĖĒ׳ ņäżļ¬ģļÉĀ Ļ▓āņØ┤ļŗż.
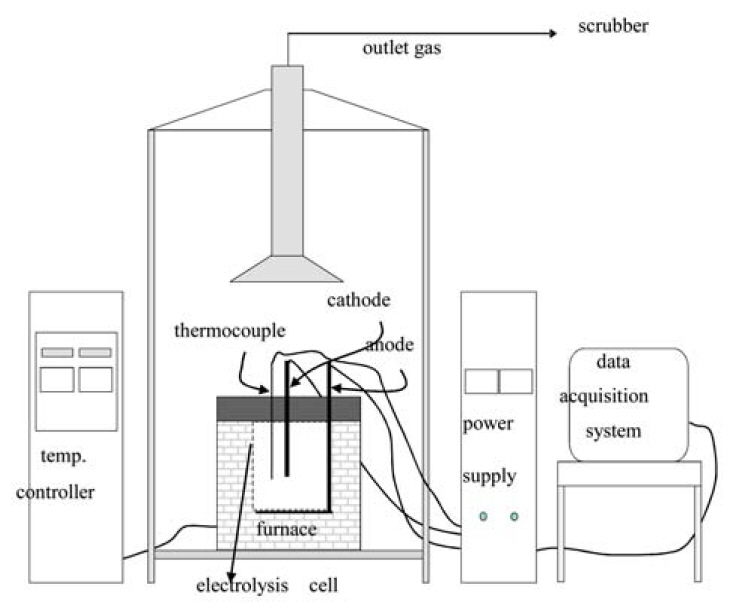
ņŗżĒŚś ņןņ╣śņØś Ļ░£ļץļÅäļź╝ ĻĘĖļ”╝ 3ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ņŚÉņä£ ļ│┤ņØ┤ļō» ņŗżĒŚś ņןņ╣śļŖö Ļ░ĆņŚ┤ļĪ£ņÖĆ ĻĄÉļźś ņĀäņøÉ, Ļ░ĆņŚ┤ļĪ£ ļé┤ļČĆņØś ņĀäĒĢ┤ņĪ░, ņŹ©ļ©Ėņ╗żĒöī, ņĀäĻĘ╣ ļ░Å ņ¦üļźś Ļ│ĄĻĖē ņןņ╣ś, ļ░£ņāØ Ļ░ĆņŖż ņ▓śļ”¼ņÜ® Ēøäļō£ ļ░Å ņŖżĒü¼ļ¤¼ļ▓ä, ņś©ļÅä, ņĀäļźś, ņĀäņĢĢ ļō▒ ļŹ░ņØ┤Ēä░ ļ¬©ļŗłĒä░ļ¦ü ļ░Å ņłśņ¦æ ņ▓śļ”¼ ņןņ╣ś ļō▒ņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ļŗż. ņĀäĒĢ┤ņĪ░ņŚÉļŖö ņøÉĒåĄĒśĢņØś graphite ļÅäĻ░Ćļŗł, ņØīĻĘ╣ņ£╝ļĪ£ļŖö ņāüĒĢśļĪ£ Ļ╣ŖņØ┤ ņĪ░ņĀłņØ┤ Ļ░ĆļŖźĒĢ£ ĒģģņŖżĒģÉ ļ┤ē(ņ¦üĻ▓Į 20Žå), ņ¢æĻĘ╣ņ£╝ļĪ£ļŖö graphite ļÅäĻ░Ćļŗł ņ×Éņ▓┤ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņĀäĒĢ┤ ĒÖśņøÉļÉ£ ņĢĪņāü ĻĖłņåŹņØś ļéÖĒĢś ļ░Å ņłśņ¦æņØ┤ ņÜ®ņØ┤ĒĢśļÅäļĪØ ĒģģņŖżĒģÉ ļ┤ē ĒĢśļŗ©ņØĆ ļ░śĻĄ¼ĒśĢņ£╝ļĪ£ ņĀ£ņ×æļÉśņŚłņ£╝ļ®░ ņĢĪņāü Nd ĻĖłņåŹņØś ņłśņ¦æņÜ®ņ£╝ļĪ£ ņøÉĒåĄĒśĢņØś Mo ļÅäĻ░Ćļŗłļź╝ ņØīĻĘ╣ ļ┤ē ņĢäļלņŚÉ ņ£äņ╣śņŗ£ņ╝░ļŗż.
ļśÉĒĢ£ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ļ¤ēņŚÉ ļö░ļØ╝ ņÜ®ņ£ĄņŚ╝ņØś ļåÆņØ┤Ļ░Ć ļŗ¼ļØ╝ņ¦Ćļ»ĆļĪ£ ņ¢æĻĘ╣ ņĀäļźś ļ░ĆļÅä(ņÜ®ņ£ĄņŚ╝Ļ│╝ ņĀæņ┤ēĒĢśļŖö graphite ļÅäĻ░Ćļŗł ņ¢æĻĘ╣ņØś ļŗ©ņ£ä ļ®┤ņĀüļŗ╣ ņĀäļźśļ¤ē)ņŚÉ ļ│ĆĒÖöļź╝ ņżä ņłś ņ׳ņ£╝ļ®░, ņØīĻĘ╣ņØĖ ĒģģņŖżĒģÉ ļ┤ēņØś ņ╣©ņ¦Ć Ļ╣ŖņØ┤ļź╝ ņĪ░ņĀłĒĢ©ņ£╝ļĪ£ņŹ© ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅä(ņÜ®ņ£ĄņŚ╝Ļ│╝ ņĀæņ┤ēĒĢśļŖö ĒģģņŖżĒģÉ ņØīĻĘ╣ņØś ļŗ©ņ£ä ļ®┤ņĀüļŗ╣ ņĀäļźśļ¤ē)ļź╝ ļ│ĆĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗż. ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅä icļŖö ĒģģņŖżĒģÉ ļ┤ēņØś ņ¦üĻ▓Į D, ņ╣©ņ¦Ć Ļ╣ŖņØ┤ h, ņĀäļźśļ¤ē IļĪ£ļČĆĒä░ ļŗżņØīĻ│╝ Ļ░ÖņØ┤ Ļ│äņé░ļÉĀ ņłś ņ׳ļŗż.
2.3 ņŗżĒŚś
ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØä ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ļ╣äņ£©ļĪ£ ņ╣Łļ¤ēĒĢśĻ│Ā ĒÖśņøÉ ņøÉļŻī Nd2O3ļź╝ NdF3ņÖĆ LiF ņ┤Øļ¤ēņØś 1.5 wt% ņ╣Łļ¤ēĒĢśņŚ¼ ņä£ļĪ£ ņל Ēś╝ĒĢ®ĒĢśņśĆļŗż. ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņ┤Øļ¤ēņØĆ 2,485~3,475 gņØ┤ņŚłņ£╝ļ®░ ņ┤łĻĖ░ Ēś╝ĒĢ®ļÉśļŖö Nd2O3 ļ¤ēņØĆ ņØ┤ņŚÉ ļ╣äļĪĆĒĢśņŚ¼ 27.9~39 gņØ┤ņŚłļŗż.
ņל Ēś╝ĒĢ®ļÉ£ ņŚ╝ņØä ņןņ×ģĒĢĀ ņłś ņ׳ļŖö ļ¦īĒü╝ ņĄ£ļīĆļĪ£ graphite ļÅäĻ░ĆļŗłņŚÉ ņןņ×ģĒĢśĻ│Ā K-typeņØś ņŹ©ļ©Ėņ╗żĒöīĻ│╝ ņØīĻĘ╣ņØĖ ĒģģņŖżĒģÉ ļ┤ēņØä ņ£äņ╣śņŗ£ņ╝░ļŗż. ņØīĻĘ╣ ļ┤ēņØś ņ╣©ņ¦Ć Ļ╣ŖņØ┤ļŖö ņŚ╝ņØ┤ ņĢĪņāüņØ┤ ļÉ£ Ēøä ņĀæņ┤ē ļ®┤ņĀüņØä Ļ│ĀļĀżĒĢśņŚ¼ Ļ▓░ņĀĢĒĢ£ļŗż. ņØ┤ļŖö Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäļź╝ Ļ▓░ņĀĢĒĢśļ»ĆļĪ£ ņżæņÜöĒĢ£ ņŗżĒŚś ļ│Ćņłś ņżæ ĒĢśļéśņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ņØīĻĘ╣ ļ┤ē ņ╣©ņ¦Ć Ļ╣ŖņØ┤ļŖö 7.3~12.5 cm, ņĀæņ┤ē ļ®┤ņĀüņ£╝ļĪ£ļŖö 52.1~84.8 cm2 ļ▓öņ£äņŚÉņä£ Ļ░Ćļ│ĆņĀüņØ┤ņŚłļŗż. ņŹ©ļ©Ėņ╗żĒöīņØĆ ļüØļŗ©ņØ┤ ņĢĪņāüņØś ņŚ╝ ņżæĻ░ä Ļ╣ŖņØ┤ņŚÉ ņśżļÅäļĪØ ņ£äņ╣śņŗ£Ēé©ļŗż. ņØ┤ļź╝ ņ£äĒĢ┤ņä£ļŖö ņŚ╝ņØ┤ ņĢĪņāüņØ┤ ļÉśņŚłņØä ļĢīņØś ņżæĻ░ä Ļ╣ŖņØ┤ņÖĆ ņÜ®ņ£ĄņŚ╝ ņāüĒĢśļČĆņŚÉņä£ņØś ņś©ļÅä ĒÄĖņ░©ļź╝ ņé¼ņĀäņŚÉ ĒīīņĢģĒĢ┤ ļæÉņ¢┤ņĢ╝ ĒĢ£ļŗż.
ņŹ©ļ©Ėņ╗żĒöīņØś ņéĮņ×ģ, ļ░£ņāØ Ļ░ĆņŖżņØś ļ░░ĻĖ░, ņĀäĒĢ┤ ņżæ ĒÖśņøÉ ņøÉļŻīņØś ņČöĻ░Ć Ēł¼ņ×ģ ļō▒ņØ┤ Ļ░ĆļŖźĒĢśļÅäļĪØ ņĀüņĀłĒ׳ Ļ░ĆĻ│ĄļÉ£ ņäĖļØ╝ļ»╣ ļ│┤ļō£ļĪ£ Ļ░ĆņŚ┤ļĪ£ļź╝ ļŹ«Ļ│Ā ĻĄÉļźś ņĀäņøÉņŚÉ ņØśĒĢ┤ Ļ░ĆņŚ┤ĒĢśņśĆļŗż. ņś©ļÅäĻ░Ć ņāüņŖ╣ĒĢśņŚ¼ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØ┤ ņÜ®ĒĢ┤ļÉśļ®┤ ņĀäĒĢ┤ņĪ░ ļé┤ ņŚ╝ņØś ļåÆņØ┤Ļ░Ć 1/2 ļé┤ņ¦Ć 1/3ļĪ£ ļé«ņĢäņ¦Ćļ»ĆļĪ£ ņ┤łĻĖ░ņŚÉ ļČĆĒö╝ ļ¼ĖņĀ£ļĪ£ ņןņ×ģĒĢśņ¦Ć ļ¬╗ĒĢ£ ļéśļ©Ėņ¦Ć ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØä ņČöĻ░Ć Ēł¼ņ×ģĒĢśĻ│Ā ņÜ®ĒĢ┤ņŗ£ņ╝░ļŗż. ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņÜ®ĒĢ┤ ņÖäļŻī Ēøä ņĀäĒĢ┤ ļ¬®Ēæ£ņś©ļÅäņŚÉ ļÅäļŗ¼ĒĢśļ®┤ ņ¦üļźś ņĀäņøÉņŚÉ ņØśĒĢ┤ ņĀäĒĢ┤ļź╝ ņŗ£ņ×æĒĢ£ļŗż. ņĀäĒĢ┤ļŖö ņĀäļźś ļ░ĆļÅäņØś ņĪ░ņĀłņØ┤ ņÜ®ņØ┤ĒĢ£ ņĀĢņĀäļźś ļ¬©ļō£ļĪ£ ļīĆļČĆļČä ņ¦äĒ¢ēļÉśņŚłĻ│Ā ņØ╝ļČĆ ņĀĢņĀäņĢĢ ļ¬©ļō£ļĪ£ļÅä ņ¦äĒ¢ēļÉśņŚłļŗż. ĻĘĖļ”╝ 4ņÖĆ 5ņŚÉ Ļ░ü ļ¬©ļō£ņŚÉņä£ņØś ņŗżĒŚś ņżæ ļīĆĒæ£ņĀüņØĖ ņĀäņĢĢĻ│╝ ņĀäļźśņØś ļ│ĆĒÖöļź╝ Ļ░üĻ░üņØś ņŗżĒŚś ņĪ░Ļ▒┤ļōżĻ│╝ ĒĢ©Ļ╗ś ļéśĒāĆļé┤ņŚłļŗż.
ņĀäĒĢ┤ ĒÖśņøÉņØ┤ ņ¦äĒ¢ēļÉśļ®┤ ņ┤łĻĖ░ ņןņ×ģļÉ£ ĒÖśņøÉ ņøÉļŻīĻ░Ć ņĀÉņ░© ņåīļ╣ä Ļ│ĀĻ░łļÉśļ»ĆļĪ£ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ļČäĒĢ┤Ļ░Ć ņØ╝ņ¢┤ļéśĻĖ░ ņĀäņŚÉ ņØ╝ņĀĢ ņŗ£Ļ░ä Ļ░äĻ▓®ņ£╝ļĪ£ ĒÖśņøÉ ņøÉļŻīļź╝ ņČöĻ░Ć Ēł¼ņ×ģĒĢ£ļŗż. ņØ┤ļĢī ņÜ®ĒĢ┤ļÅäļź╝ ņ┤łĻ│╝ĒĢśņ¦Ć ņĢŖļÅäļĪØ Ēł¼ņ×ģļ¤ēĻ│╝ Ēł¼ņ×ģ ņåŹļÅäļź╝ ņĀäĒĢ┤ ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ņĀüņĀłĒ׳ Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ņČöĻ░Ć Ēł¼ņ×ģ ņåŹļÅäļŖö ņĀäĒĢ┤ ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ņĢäļל ņŗØ(2)ņŚÉ ņØśĒĢ┤ ņāØņä▒ļÉśļŖö ņŗ£Ļ░äļŗ╣ Nd ĻĖłņåŹ ļ¤ēņ£╝ļĪ£ļČĆĒä░ ņŗ£Ļ░äļŗ╣ ĒĢäņÜö Nd2O3ļ¤ēņØä ĒÖśņé░ĒĢśņŚ¼ Ļ▓░ņĀĢĒĢ£ļŗż. ņŗØ(2)ņŚÉņä£ nņØĆ Nd ĻĖłņåŹņØś ĒÖöĒĢÖļŗ╣ļ¤ēņØ┤ļ®░ FļŖö Faraday ņāüņłśņØ┤ļŗż. ļśÉĒĢ£ ņŗØ(2)ļĪ£ļČĆĒä░ ļÅÖņØ╝ĒĢ£ ņĀäļźś ĒÜ©ņ£©ņØ╝ņ¦ĆļØ╝ļÅä ņĀäļźśļ¤ēņØä ļŗ¼ļ”¼ĒĢśļ®┤ ļŗ©ņ£äņŗ£Ļ░ä ļŗ╣ ņČöĻ░Ć Ēł¼ņ×ģĒĢ┤ņĢ╝ ĒĢĀ Nd2O3ņØś ļ¤ēļÅä ļŗ¼ļ”¼ĒĢ┤ņĢ╝ ĒĢ©ņØä ņĢī ņłś ņ׳ļŗż. ļŗżņŗ£ ļ¦ÉĒĢśļ®┤, ņĀäļźśļ¤ēņØä ļŗ¼ļ”¼ĒĢśņŚ¼ ņŗżĒŚśĒĢĀ Ļ▓ĮņÜ░ ņČöĻ░Ć Ēł¼ņ×ģ ņŗ£Ļ░ä Ļ░äĻ▓®ņØä ĻĘĖļīĆļĪ£ ļæÉĻ│Ā 1ĒÜī ņČöĻ░Ć Ēł¼ņ×ģļ¤ēņØä ļŗ¼ļ”¼ĒĢśĻ▒░ļéś, 1ĒÜī ņČöĻ░Ć Ēł¼ņ×ģļ¤ēņØä ĻĘĖļīĆļĪ£ ļæÉĻ│Ā ņČöĻ░Ć Ēł¼ņ×ģ ņŗ£Ļ░ä Ļ░äĻ▓®ņØä ļŗ¼ļ”¼ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĀäļźś ĒÜ©ņ£©ņØä 70~80%ļĪ£ Ļ░ĆņĀĢĒĢśĻ│Ā, ņŗżĒŚś ņŗ£ ņśłņĀĢļÉ£ ņØĖĻ░Ć ņĀäļźśņŚÉ ņāüņØæĒĢśļÅäļĪØ ņČöĻ░Ć Ēł¼ņ×ģ ņåŹļÅäļź╝ Ļ▓░ņĀĢĒĢśņśĆļŗż.
ņĀäĒĢ┤ ĒÖśņøÉņØ┤ ņ¦äĒ¢ēļÉ©ņŚÉ ļö░ļØ╝, ņØīĻĘ╣ņŚÉņä£ ĒÖśņøÉļÉ£ ņĢĪņāüņØś Nd ĻĖłņåŹņØĆ ņĀäĒĢ┤ņĪ░ ĒĢśļČĆņØś ņłśņ¦æ ņÜ®ĻĖ░ļĪ£ ņ╣©ņĀäļÉśņ¢┤ ņīōņØ┤Ļ▓ī ļÉ£ļŗż. ĒĢ£ĒÄĖ ņ¢æĻĘ╣ņŚÉņä£ļŖö graphiteņÖĆ ņé░ņåī ņØ┤ņś©ņØś ļ░śņØæņ£╝ļĪ£ CO ļśÉļŖö CO-CO2Ļ░Ć ļ░£ņāØĒĢśļ®░ [18-20] Ēøäļō£ļź╝ ĒåĄĒĢ┤ ļ░░ĻĖ░ļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĀäĒĢ┤ ņżæ ĒÖśņøÉ ņøÉļŻīņØĖ Nd2O3Ļ░Ć ņŗŁņŚ¼ ņ░©ļĪĆ ņČöĻ░Ć Ēł¼ņ×ģļÉśņŚłņ£╝ļ®░, ņĀäĒĢ┤ ņóģļŻī Ēøä ņĀäĒĢ┤ņĪ░ļŖö Ļ░ĆņŚ┤ļĪ£ ļé┤ņŚÉņä£ Ļ│ĄļףļÉśņŚłļŗż.
ļāēĻ░üļÉ£ ņĀäĒĢ┤ņĪ░ļź╝ ĒīīņćäĒĢśņŚ¼ ļé┤ļČĆņØś Mo ļÅäĻ░ĆļŗłļĪ£ļČĆĒä░ Nd ĻĖłņåŹņØä ĒÜīņłśĒĢśņśĆļŗż. ņØ┤ļĢī Nd ĻĖłņåŹņØĆ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝Ļ│╝ Mo ļÅäĻ░ĆļŗłļĪ£ļČĆĒä░ ņēĮĻ▓ī ļČäļ”¼ļÉśņŚłļŗż. ĒÜīņłśļÉ£ ĻĖłņåŹņØś ļ¼┤Ļ▓īņÖĆ ņĀäĒĢ┤ ņżæ Ļ│ĄĻĖēļÉ£ ņ¦üļźś ņĀäĻĖ░ņŚÉļäłņ¦ĆļĪ£ļČĆĒä░ ņĀäļźś ĒÜ©ņ£©ņØä Ļ│äņé░ĒĢśĻ│Ā ņŗżĒŚś ņĀä Ļ░ĆņĀĢ Ļ░ÆĻ│╝ ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż. ļśÉĒĢ£ XRD (Rigaku X-ray diffractometer with Cu K╬▒ radiation(╬╗ = 1.54178Ōä½)), GDMS (MSI Glow Discharge Mass Spectrometry, GD90), ņé░ņåī/ņ¦łņåī (LECO TCH600) ļČäņäØņØä ĒåĄĒĢśņŚ¼ ņāü ļČäņäØĻ│╝ ĻĖłņåŹņØś ņł£ļÅä, ĻĖłņåŹ ļ░Å ļ╣äĻĖłņåŹ ļČłņł£ļ¼╝ļōżņØä ĒīīņĢģĒĢśņśĆļŗż.
3. ņŗżĒŚśĻ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1 ņĀäĒĢ┤ņś©ļÅäņØś ņśüĒ¢ź
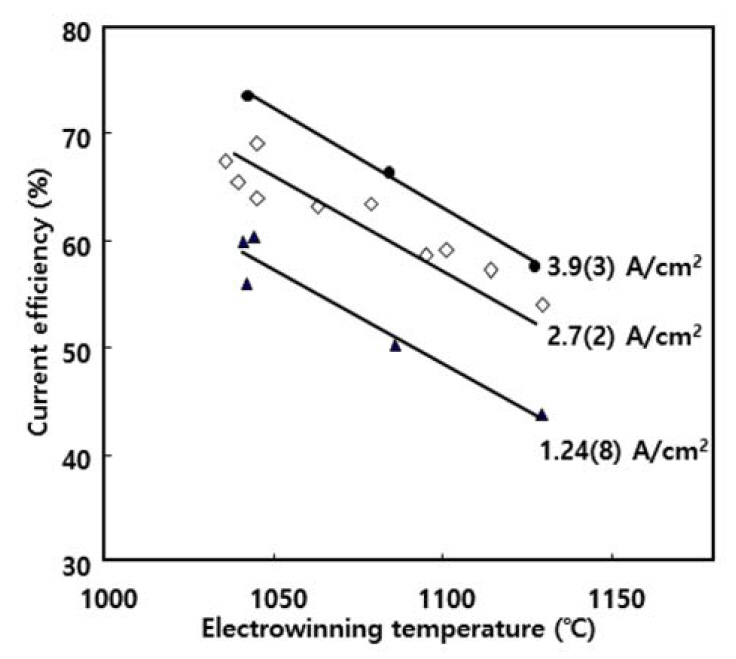
ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņ”ØĻĖ░ņĢĢĻ│╝ ņäØņČ£ ĻĖłņåŹņØś ņ×¼ ņÜ®ĒĢ┤ [20-23]ļź╝ Ļ│ĀļĀżĒĢśļ®┤ ņŗżĒŚś ņś©ļÅäļŖö Nd ĻĖłņåŹņØś ņ£ĄņĀÉ(1021 ┬░C) ņØ┤ņāüņŚÉņä£ Ļ░ĆļŖźĒĢ£ ĒĢ£ ļé«ņØĆ Ļ▓āņØ┤ ņóŗļŗż. ĻĘĖļ¤¼ļéś ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņ£ĀļÅÖņä▒Ļ│╝ ĒÖśņøÉ ņøÉļŻī Nd2O3ņØś ņÜ®ĒĢ┤ļÅäļź╝ Ļ│ĀļĀżĒĢśļ®┤ ņś©ļÅäĻ░Ć ļåÆņØĆ Ļ▓āņØ┤ ņóŗļŗż. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŗżĒŚś ņś©ļÅä 1030~1130 ┬░CņØś ļ▓öņ£äņŚÉņä£ ņś©ļÅäņŚÉ ļö░ļźĖ ņĀäļźś ĒÜ©ņ£©ņØś ļ│ĆĒÖöļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż.
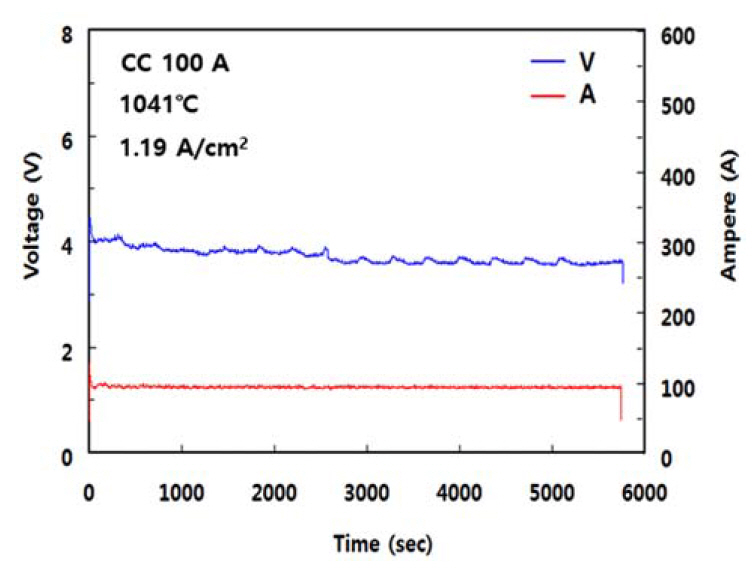
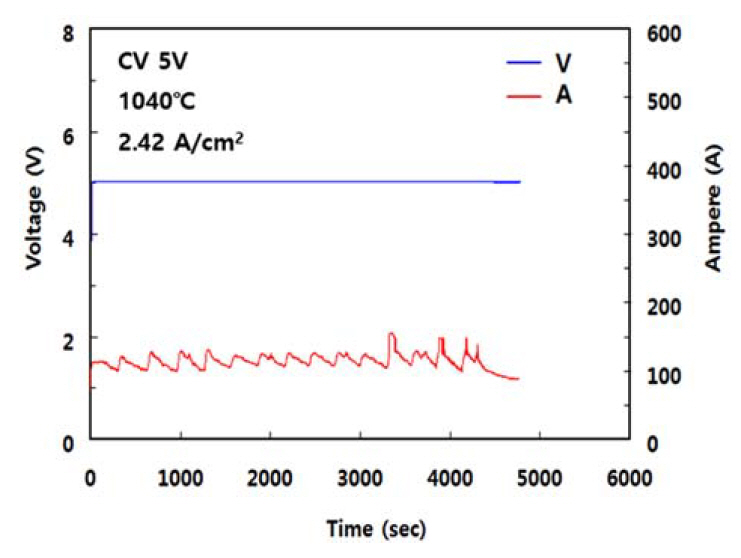
ņŗżĒŚś Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 6ņŚÉ ļéśĒāĆļéĖļŗż. ĻĘĖļ”╝ 6ņŚÉņä£ ļ│┤ņØ┤ļō»ņØ┤ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņØś ņäĖĻĖ░ņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņĀäĒĢ┤ņś©ļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ņĀäļźś ĒÜ©ņ£©ņØĆ Ļ▒░ņØś ņ¦üņäĀņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. ņØ┤ļŖö ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ņäżļ¬ģļÉĀ ņłś ņ׳ļŗż. ņĀäĒĢ┤ ĒÖśņøÉļÉ£ ĒؼĒåĀļźś ĻĖłņåŹņØś ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņŚÉ ņØśĒĢ£ ņ×¼ ņÜ®ĒĢ┤ļŖö ņל ņĢīļĀżņĀĖ ņ׳ļŗż [20-23]. Chen ļō▒ņØĆ [21] ņÜ®ņ£Ą NdF3-LiFĻ│äņŚÉņä£ Nd ĻĖłņåŹņØś ņÜ®ĒĢ┤ ņŗżĒŚśņØä ĒåĄĒĢśņŚ¼ NdF2ņÖĆ NdOFĻ░Ć ĒśĢņä▒ļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā Shimada ļō▒ņØĆ [22,23] ņÜ®ņ£Ą LiF ļé┤ņŚÉņä£ Nd ĻĖłņåŹņØ┤ ņÜ®ĒĢ┤ļÉśņ¢┤ NdF2ņÖĆ NdF3Ļ░Ć ĒśĢņä▒ļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░ ņØ┤ ļĢīņØś ņÜ®ĒĢ┤ Ļ▒░ļÅÖņØä ņĢäļĀłļŗłņÜ░ņŖżņØś ļ░śņØæ ņåŹļÅäļĪĀ ņĀüņ£╝ļĪ£ ņäżļ¬ģĒĢśņśĆļŗż. ņ”ē, ņä£ļĪ£ ļŗżļźĖ ņś©ļÅäņŚÉņä£ ņÜ®ĒĢ┤ ņŗ£Ļ░ä tņØ╝ ļĢī ņÜ®ņ£ĄņŚ╝ ļé┤ ņÜ®ņ¦ł ĻĖłņåŹņØś ļåŹļÅä xļź╝ ņŗżĒŚśņØä ĒåĄĒĢ┤ x=Kt ĻĘ╝ņé¼ņŗØņ£╝ļĪ£ ļéśĒāĆļéĖ Ēøä Ļ░ü ņś©ļÅäņŚÉņä£ņØś KĻ░ÆņØä ĒÅēĻ░ĆĒĢśņśĆļŗż. ņŚ¼ĻĖ░ņä£ KļŖö ņÜ®ĒĢ┤ ļ░śņØæņØś ņåŹļÅä ņāüņłśņØ┤ļŗż. ņØ┤ļĪ£ļČĆĒä░ lnKņŚÉ ļīĆĒĢ£ ņĢäļĀłļŗłņÜ░ņŖż ļÅäĒæ£, ņ”ē, lnK vs. 1/TņØś Ļ┤ĆĻ│ä(K = Ae(-Ea/T))ļĪ£ļČĆĒä░ ņÜ®ĒĢ┤ņŚÉ ļīĆĒĢ£ ĒÖ£ņä▒ĒÖö ņŚÉļäłņ¦Ćļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗż. ņØ┤ļōżņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ ĻĖ░ņ┤łĒĢĀ ļĢī ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ×¼ ņÜ®ĒĢ┤ ĒśäņāüņØ┤ ļ░£ņāØĒĢśļ®░ ņś©ļÅäĻ░Ć ņś¼ļØ╝Ļ░łņłśļĪØ ņ╗żņ¦Éņ£╝ļĪ£ņŹ© ņĀäļźś ĒÜ©ņ£©ņØ┤ Ļ░ÉņåīĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļśÉĒĢ£ ņØ┤ļĪ£ļČĆĒä░ ņś©ļÅäņØś ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņ£ĀļÅÖņä▒ ņ”ØĻ░ĆĻ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ĻĖŹņĀĢņĀü ĒÜ©Ļ│╝ļ│┤ļŗż ņäØņČ£ ĻĖłņåŹņØś Ļ│Āņś© ņ×¼ ņÜ®ĒĢ┤Ļ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ļČĆņĀĢņĀü ĒÜ©Ļ│╝Ļ░Ć ļŹö Ēü¼ļŗżļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż.
ĻĘĖļ”╝ 6ņŚÉ ņĀäĒĢ┤ņś©ļÅäņÖĆ ņĀäļźś ĒÜ©ņ£©ņØś Ļ┤ĆĻ│äļź╝ ņ¦üņäĀņ£╝ļĪ£ Ēæ£ņŗ£ĒĢśņśĆņ£╝ļéś ņś©ļÅäĻ░Ć ļé«ņĢäņ¦łņłśļĪØ ĻĘĖ ĻĖ░ņÜĖĻĖ░Ļ░Ć ļŗżņåī Ļ░ÉņåīĒĢśļŖö ļō»ĒĢśļŗż. ņØ┤ļŖö ņś©ļÅäĻ░Ć Ļ░ÉņåīĒĢ©ņŚÉ ļö░ļØ╝ ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņ£ĀļÅÖņä▒ņØ┤ ņ¦Ćļéśņ╣śĻ▓ī Ļ░ÉņåīĒĢ£ ļŹ░ ĻĖ░ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż.
ņé¼ņŗż, ņĀäĒĢ┤ņś©ļÅäĻ░Ć 1030~1040 ┬░C ņĀĢļÅäļĪ£ ļäłļ¼┤ ļé«ņØä Ļ▓ĮņÜ░, ņĀäļźśĻ░Ć ņ×ÉņŻ╝ ļ®łņČöĻ│Ā ņĀäņĢĢņØĆ ņĀĢļźśĻĖ░ņØś ņäżņĀĢ ĒĢ£Ļ│äĻ░ÆņØä ļäśņ¢┤ ņĀäĒĢ┤Ļ░Ć ņżæļŗ©ļÉśņŚłļŗż. ņØ┤ļŖö ņĀäĒĢ┤ņ¦Ćņ¦ĆņŚ╝ņØś ņĀÉļÅä ņ”ØĻ░Ć(ņ£ĀļÅÖņä▒ Ļ░Éņåī)Ļ░Ć ņĀäļźśņØś ĒØÉļ”äņØä ņĀĆĒĢśņŗ£Ēé¼ ļ┐É ņĢäļŗłļØ╝ ņ¢æĻĘ╣ņŚÉņä£ņØś ļ░£ņāØ Ļ░ĆņŖż ļ░░ņČ£ļÅä ņ¢┤ļĀĄĻ▓ī ĒĢśņŚ¼ ņ¢æĻĘ╣ Ēæ£ļ®┤ņŚÉņä£ņØś ņ¦ĆņåŹņĀü ņé░ĒÖö ļ░śņØæņØä ņĀĆĒĢ┤ĒĢśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ĒĢ┤ņäØļÉ£ļŗż. ļö░ļØ╝ņä£ ņĀäĒĢ┤ņś©ļÅäļŖö ņ×æņŚģņä▒ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņĀäļźś ĒÜ©ņ£©ņØś Ļ┤ĆņĀÉņŚÉņä£ 1040~1050 ┬░C ļ▓öņ£äĻ░Ć Ļ░Ćņן ņĀüņĀłĒĢśņśĆļŗż.
3.2 ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņØś ņśüĒ¢ź
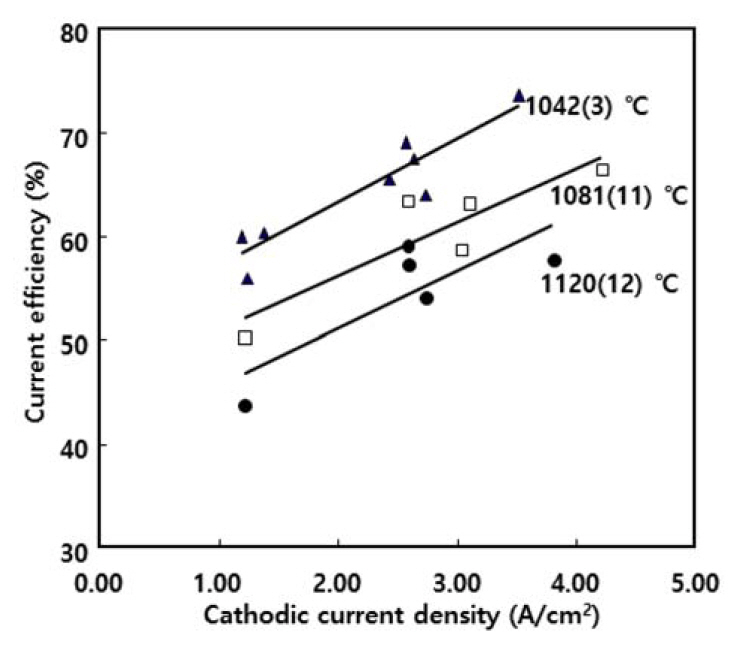
ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäĻ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢśņśĆļŗż. ĻĘĖļ”╝ 7ņØĆ ņä£ļĪ£ ļŗżļźĖ ņś©ļÅäņŚÉņä£ ņĀäļźś ĒÜ©ņ£©Ļ│╝ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņØś Ļ┤ĆĻ│äļź╝ ļéśĒāĆļéĖļŗż. ļŹ░ņØ┤Ēä░Ļ░Ć ļŗżņåī ņé░ĒżļÉśņ¢┤ ņ׳ņ£╝ļéś ņĀäĒĢ┤ņś©ļÅäņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņĀäļźś ĒÜ©ņ£©ņØĆ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā ļīĆņ▓┤ļĪ£ ņäĀĒśĢņĀüņØĖ Ļ┤ĆĻ│äļź╝ ļéśĒāĆļé┤ņŚłļŗż. ņØ┤ņŚÉ ļīĆĒĢ£ ņäżļ¬ģņØĆ Choi ļō▒ņØś ļ│┤Ļ│Āļź╝ [24] ņ░ĖĻ│ĀĒĢĀ ņłś ņ׳ļŗż. Choi ļō▒ņØĆ ņåīļōÉļ│┤ļĀłņØ┤ĒŖĖ ņÜ®ņ£ĄņŚ╝ņØä ņØ┤ņÜ®ĒĢ£ ņ▓ĀņØś ņĀäĒĢ┤ ĒÖśņøÉ ņŗżĒŚśņŚÉņä£, Ēī©ļ¤¼ļŹ░ņØ┤ ļ░śņØæ ņŚåņØ┤ ņÜ®ņ£ĄņŚ╝ ļé┤ņŚÉ ĒØÉļź┤ļŖö ņĀäņ×É ņĀäļźś(electronic current)ļź╝ ņĀäļźś ņåÉņŗż, ņ”ē ņĀäĒĢ┤ņŗ£ņŖżĒģ£ņØś ņĀäļźś ĒÜ©ņ£©ņØä ļé«ņČöļŖö ņÜöņåīļĪ£ ļ│┤Ļ│Ā, ņģĆ ņĀäņĢĢņŚÉ ļö░ļźĖ ņĀäļźś ļ░ĆļÅäņØś ļ│ĆĒÖöņÖĆ ņĀäņ×É ņĀäļźśņØś ĻĖ░ņŚ¼ļÅäļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż. ņØ┤ņŚÉ ļö░ļź┤ļ®┤ ņģĆ ņĀäņĢĢņØś ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ņĀäļźś ļ░ĆļÅäņØś ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ņ┤Ø ņĀäļźśņŚÉ ļīĆĒĢ£ ņĀäņ×É ņĀäļźśņØś ĻĖ░ņŚ¼ļÅäĻ░Ć ļīĆĒÅŁņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. ņ”ē, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĀäļźś ļ░ĆļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ņĀäļźś ĒÜ©ņ£©ņØś ņĀĆĒĢś ņøÉņØĖņØ┤ ļÉśļŖö ņĀäņ×É ņĀäļźśņØś ĻĖ░ņŚ¼ļÅäĻ░Ć Ļ░ÉņåīĒĢśņŚ¼ ņĀäļźś ĒÜ©ņ£©ņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ĒĢ┤ņäØļÉ£ļŗż.
ĒĢ£ĒÄĖ, ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäĻ░Ć ļäłļ¼┤ ņ╗żņ¦Ćļ®┤ ņÜ®ņ£ĄņŚ╝ņØś ņś©ļÅäĻ░Ć Ļ│╝ņ×ē ņāüņŖ╣ĒĢśņŚ¼ ņäØņČ£ ĻĖłņåŹņØś ņ×¼ ņÜ®ĒĢ┤Ļ░Ć ņ┤ēņ¦äļÉśĻ▒░ļéś, ĻĖłņåŹņØś ņāØņä▒ ņåŹļÅäĻ░Ć Nd ņ¢æņØ┤ņś©ņØś ĒÖĢņé░ ņåŹļÅäļ│┤ļŗż Ēü¼Ļ▓ī ļÉśņ¢┤ ņØīĻĘ╣ņŚÉņä£ Nd ņ¢æņØ┤ņś©ņØś ņł£Ļ░äņĀü Ļ│ĀĻ░łņØä ņ┤łļלĒĢĀ Ļ▓ĮņÜ░ ņśżĒ׳ļĀż ņĀäļźś ĒÜ©ņ£©ņØ┤ Ļ░ÉņåīĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ ļ▓öņ£äņŚÉņä£ļŖö ņØ┤ļź╝ ĒÖĢņØĖĒĢśņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļ®░ ņØ┤ņŚÉ ļīĆĒĢ┤ņä£ļŖö ņČöĻ░ĆņĀüņØĖ ņŗżĒŚśņØ┤ ĒĢäņÜöĒĢśļŗż.
Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņÖĆ ņĀäĒĢ┤ņś©ļÅäļź╝ ĒĢ©Ļ╗ś Ļ│ĀļĀżĒĢĀ ļĢī ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅä 3.6 A/cm2, ņĀäĒĢ┤ņś©ļÅä 1045 ┬░CņŚÉņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ņĄ£Ļ│Ā ņĀäļźś ĒÜ©ņ£© 73.6%ļź╝ ļéśĒāĆļé┤ņŚłļŗż.
3.3 Nd2O3 Ēł¼ņ×ģ ņåŹļÅäņØś ņśüĒ¢ź
ņĢ×ņä£ ņŗżĒŚś ļ░®ļ▓ĢņŚÉņä£ ĻĖ░ņ×¼ĒĢśņśĆļō»ņØ┤ ņŗØ(2)ļĪ£ļČĆĒä░ ļÅÖņØ╝ĒĢ£ ņĀäļźś ĒÜ©ņ£©ņØ╝ņ¦ĆļØ╝ļÅä ņĀäļźśļ¤ēņØä ļŗ¼ļ”¼ĒĢśļ®┤ ļŗ©ņ£äņŗ£Ļ░ä ļŗ╣ ņČöĻ░Ć Ēł¼ņ×ģĒĢ┤ņĢ╝ ĒĢĀ Nd2O3ņØś ļ¤ēļÅä ļŗ¼ļ”¼ĒĢ┤ņĢ╝ ĒĢ©ņØä ņĢī ņłś ņ׳ļŗż. ņ”ē, ņĀäļźśļ¤ēĻ│╝ Nd2O3 Ēł¼ņ×ģ ņåŹļÅä(ļŗ©ņ£äņŗ£Ļ░ä ļŗ╣ ņČöĻ░Ć Ēł¼ņ×ģĒĢ┤ņĢ╝ ĒĢĀ Nd2O3ņØś ļ¤ē)ļŖö ņĀĢļ╣äļĪĆ Ļ┤ĆĻ│äņŚÉ ņ׳ļŗż.
ņØīĻĘ╣ņØś ņéĮņ×ģ Ļ╣ŖņØ┤Ļ░Ć ļÅÖņØ╝ĒĢĀ Ļ▓ĮņÜ░ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäļŖö ņĀäļźśļ¤ēĻ│╝ ņĀĢļ╣äļĪĆ Ļ┤ĆĻ│äņØ┤ļ»ĆļĪ£ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņÖĆ ĒÖśņøÉ ņøÉļŻī Nd2O3ņØś Ēł¼ņ×ģ ņåŹļÅäļŖö ņĀĢļ╣äļĪĆĒĢĀ Ļ▓āņØ┤ļŗż. ļö░ļØ╝ņä£ Nd2O3 Ēł¼ņ×ģ ņåŹļÅäĻ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäĻ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źĻ│╝ ļÅÖņØ╝ĒĢ£ Ļ▓ĮĒ¢źņØä ļ│┤ņØ╝ Ļ▓āņØ┤ļŗż.
ņŗżĒŚś Ļ▓░Ļ│╝ņØś Ļ▓Ćņ”ØņØä ņ£äĒĢśņŚ¼ ĻĘĖļ”╝ 7ņŚÉņä£ ņØīĻĘ╣ņØś ņéĮņ×ģ Ļ╣ŖņØ┤Ļ░Ć ļÅÖņØ╝ĒĢ£ ņŗżĒŚśļ¦īņØä ņäĀĒāØĒĢśņŚ¼ ĻĘĖļ”╝ 8ņŚÉ ņĀäļźś ĒÜ©ņ£©Ļ│╝ Nd2O3 Ēł¼ņ×ģ ņåŹļÅäņØś Ļ┤ĆĻ│äļź╝ ļéśĒāĆļé┤ņŚłļŗż. ņĢ×ņä£ņØś ņśłņĖĪĻ│╝ Ļ░ÖņØ┤, ņĀäļźś ĒÜ©ņ£©ņØĆ Nd2O3ņØś Ēł¼ņ×ģ ņåŹļÅäņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśņśĆļŗż. ļśÉĒĢ£ ĻĘĖļ”╝ņŚÉņä£ 3 ņóģļźśņØś ņä£ļĪ£ ļŗżļźĖ ņŗ¼ļ│╝ņØ┤ ļéśĒāĆļé┤ ļō» ņĀäļźś ļ░ĆļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ Nd2O3ņØś Ēł¼ņ×ģ ņåŹļÅäļÅä ņ”ØĻ░ĆĒĢśļŖöļŹ░, ņØ┤ļŖö Nd2O3ņØś ņČöĻ░Ć Ēł¼ņ×ģ ņåŹļÅäļź╝ ņØĖĻ░Ć ņĀäļźśļ¤ēņŚÉ ļö░ļØ╝ ņāüņØæĒĢśĻ▓ī ļ│ĆĒÖöņŗ£ņ╝░ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.
ĒĢ£ĒÄĖ, ĻĘĖļ”╝ 8ņŚÉņä£ ļÅÖņØ╝ĒĢ£ ņČöĻ░Ć Ēł¼ņ×ģ ņåŹļÅäņŚÉņä£ņØś ņĀäļźś ĒÜ©ņ£© ņ░©ņØ┤ļŖö ņĀäĒĢ┤ņś©ļÅäņØś ņ░©ņØ┤ ļĢīļ¼ĖņØ┤ļ®░ ņØ┤ņŚÉ ļīĆĒĢ┤ņä£ļŖö 3ņØś 1ņĀłņŚÉņä£ ņäżļ¬ģļÉśņŚłļŗż.
3.4 ņäØņČ£ĻĖłņåŹ NdņØś ļČäņäØ
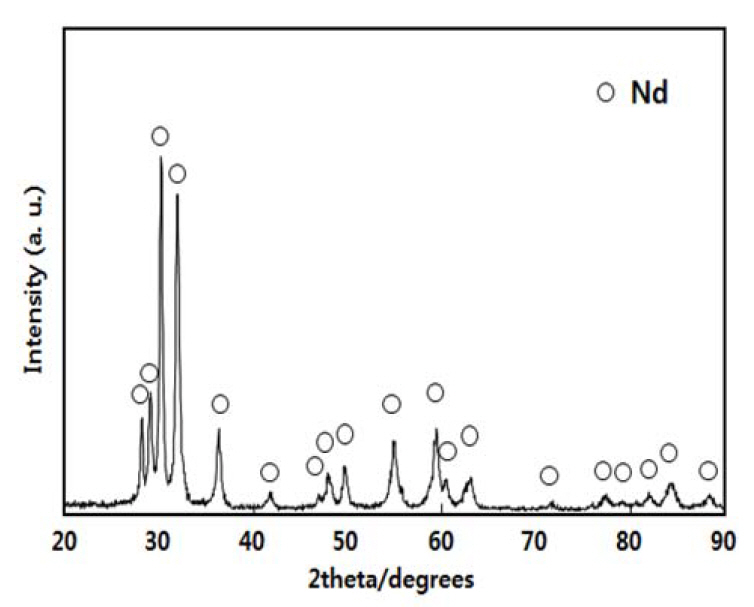
ĒÜīņłśļÉ£ Nd ĻĖłņåŹņØś ņé¼ņ¦ä ņØ╝ļČĆļź╝ ĻĘĖļ”╝ 9ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 9ņØś (a), (b) ļæÉ ņ×ēĻ││ņØĆ Ļ░üĻ░ü ĻĘĖļ”╝ 4ņÖĆ 5ņŚÉ ņāüņØæĒĢśļŖö Ļ▓░Ļ│╝ļ¼╝ļĪ£ņä£ Ļ░ü ņŗżĒŚśņŚÉņä£ņØś ņĀäļźś ĒÜ©ņ£©Ļ│╝ ņ×ēĻ││ ļ¼┤Ļ▓īļÅä ĒĢ©Ļ╗ś ĻĖ░ņ×¼ĒĢśņśĆļŗż. ņäØņČ£ ĻĖłņåŹņØś ĒÜīņłś ļ░®ļ▓ĢņØĆ ņŗżĒŚś ļČĆļČäņŚÉ ņ¢ĖĻĖēļÉśņ¢┤ ņ׳ļŗż. ļśÉĒĢ£ ĻĘĖļ”╝ 10ņŚÉ ļéśĒāĆļéĖ ņäØņČ£ ĻĖłņåŹņØś XRD Ēī©Ēä┤ņ£╝ļĪ£ļČĆĒä░ ĒÜīņłśļÉ£ ĻĖłņåŹņØĆ Nd ļŗ©ņāüņ×äņØä ņĢī ņłś ņ׳ļŗż.
GDMSņÖĆ ņé░ņåī/ņ¦łņåī ļČäņäØņØä ĒåĄĒĢśņŚ¼ ĒÜīņłś ĻĖłņåŹņØś ņł£ļÅäņÖĆ ļČłņł£ļ¼╝ļōżņØä ņĪ░ņé¼ĒĢśņśĆļŗż. GDMSļČäņäØņØś Ļ▓ĮņÜ░, ņŖżĒŹ╝Ēä░ļ¦üņ£╝ļĪ£ ņŗ£ļŻī Ēæ£ļ®┤ņØś ņśżņŚ╝Ļ│╝ ņé░ĒÖö Ēö╝ļ¦ēņØä ņĀ£Ļ▒░ĒĢ£ Ēøä ļČäņäØņØä 3ĒÜī ņŗżņŗ£ĒĢśņśĆĻ│Ā Ļ▓░Ļ│╝ņ╣śļź╝ ĒÅēĻĘĀĒĢśņŚ¼ Ēæ£ 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. 1 ppm ļ»Ėļ¦īņØś ļ»Ėļ¤ē ņøÉņåīļōż(T.E)ņØĆ ĻĖ░ņ×¼ļź╝ ņāØļץĒĢśņśĆļŗż. Ēæ£ 2ņŚÉ ņé░ņåī/ņ¦łņåī ļČäņäØĻ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ļČäņäØ Ļ░ÆļōżņØĆ ņé░ņåī/ņ¦łņåī Ļ░üĻ░üņŚÉ ļīĆĒĢ£ blank ņŗ£ļŻīņÖĆ ļæÉ ņóģļźśņØś Ēæ£ņżĆ ņŗ£ļŻī(O: 35┬▒5, 112┬▒4 ppm, N: 60┬▒14, 90┬▒10 ppm)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ│┤ņĀĢļÉśņŚłļŗż.
Ēæ£ 1ļĪ£ļČĆĒä░ ņĢī ņłś ņ׳ļō»ņØ┤, ĒÜīņłś ĻĖłņåŹņØĆ 99.87%ņØś ņł£ļÅäļź╝ ļéśĒāĆļé┤ņŚłļŗż. Nd ņØ┤ņÖĖņŚÉ Ļ▓ĆņČ£ļÉ£ Pr, Dy ļō▒ 6Ļ░Ćņ¦Ć ĒؼĒåĀļźś ņøÉņåīļōżņØĆ ĒؼĒåĀļźś ņĀĢĻ┤æņØś ņĀ£ļĀ© ņŗ£ ļČäļ”¼ņĀĢņĀ£ ņĀĢļÅäņŚÉ ĻĖ░ņØĖĒĢśņŚ¼ ņ×öļźśĒĢ£ Ļ▓āņØ┤ļ®░, ĻĘĖ ņżæ ĒŖ╣Ē׳ PrņØĆ ņŻ╝ĻĖ░ņ£©Ēæ£ ņāüņŚÉņä£ NdņÖĆ ņØ┤ņøāĒĢśļŖö ņøÉņåīļĪ£ņä£ NdņÖĆņØś ļČäļ”¼ņĀĢņĀ£ ļé£ļÅäĻ░Ć ņ╗żņä£ ņøÉļŻīņØĖ Nd2O3ņŚÉ ņāüļīĆņĀüņ£╝ļĪ£ ļŗżļ¤ē ņ×öņĪ┤ĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤¼ļéś Nd ĻĖłņåŹņØś ņĄ£ļīĆ ņłśņÜöņ▓śņØĖ NdĻ│ä ņśüĻĄ¼ņ×ÉņäØņØś ņĀ£ņĪ░ņŚÉ, ņĄ£ĻĘ╝ PrņØ┤ ĒżĒĢ©ļÉ£ Nd-Pr ĻĖłņåŹņØ┤ ņé¼ņÜ®ļÉśĻ│Ā, ņś©ļÅäņŚÉ ļīĆĒĢ£ ļ│┤ņ×ÉļĀź ĒŖ╣ņä▒ Ļ░£ņäĀņØä ņ£äĒĢ┤ DyĻ░Ć ņ▓©Ļ░Ć ņøÉņåī(Nd-Fe-B ĒĢ®ĻĖł ņżæ ĒåĄņāü 3~5 wt% ņ▓©Ļ░Ć)ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņØīņØä Ļ│ĀļĀżĒĢĀ ļĢī [25-27], ņåīļ¤ēņØś PrĻ│╝ DyļŖö ļČłņł£ļ¼╝ļĪ£ Ļ░äņŻ╝ļÉĀ ņØ┤ņ£ĀĻ░Ć ņŚåļŗż. ļö░ļØ╝ņä£ ĒÜīņłśļÉ£ ĻĖłņåŹņØ┤ ņśüĻĄ¼ņ×ÉņäØņÜ®ņØ╝ ļĢī Ēæ£ 1Ļ│╝ 2ļĪ£ļČĆĒä░ ĻĖłņåŹņØś ņł£ļÅäļŖö 99.9% ņØ┤ņāüņ£╝ļĪ£ Ļ░äņŻ╝ļÉśņ¢┤ļÅä ņóŗņØä Ļ▓āņØ┤ļŗż.
ĻĘĖ ļ░¢ņØś ļČłņł£ļ¼╝ļōżņØĆ ļīĆļČĆļČä ņøÉļŻī Nd2O3ņÖĆ ĻĖłņåŹļČłĒÖöļ¼╝ņØś ņāØņé░ Ļ│ĄņĀĢ ņżæ ņĘ©ĻĖē ņÜ®ĻĖ░, ļé┤ĒÖöņ×¼, Ēł¼ņ×ģ ļČĆņ×Éņ×¼ ļō▒ņ£╝ļĪ£ļČĆĒä░ ļ╣äļĪ»ļÉśņŚłņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļśÉĒĢ£ ņĀäĒĢ┤ Ļ│╝ņĀĢņŚÉņä£ graphite ļÅäĻ░Ćļŗłļź╝ ņĀäĒĢ┤ņĪ░ņØ┤ņ×É ņ¢æĻĘ╣ņ£╝ļĪ£ ņé¼ņÜ® Ē¢łņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ│┤ņ×ÉļĀźņŚÉ ĒĢ┤ļĪ£ņÜ┤ CĻ░Ć 2.3 ppmņŚÉ ļČłĻ│╝ĒĢśņśĆļŗż. ļ│┤ņ×ÉļĀźņØĆ ļ▓īĒü¼ ņ×ÉņäØ ņĀ£ņĪ░ ņŗ£ ņåīĻ▓░ ņŚ┤ņ▓śļ”¼ Ļ│ĄņĀĢņØä Ļ▒░ņ╣śļ®░ ņ¢ćĻ│Ā ĻĘĀņØ╝ĒĢ┤ņ¦ĆļŖö Ļ▓░ņĀĢļ”ĮĻ│ä Nd-rich phaseņŚÉ ņØśĒĢ┤ Ļ▓░ņĀĢļ”ĮĻ░ä ļČäļ”¼(magnetic decoupling) ĒÜ©Ļ│╝Ļ░Ć ņ£Āļ░£ļÉśņ¢┤ Ēü¼Ļ▓ī ņ”ØĻ░ĆļÉ£ļŗż [27,28]. ĻĘĖļ¤¼ļéś ļČłņł£ļ¼╝ CļŖö ņåīĻ▓░ ņŚ┤ņ▓śļ”¼ Ļ│ĄņĀĢ ņżæ Nd-rich phaseņŚÉ ĒÄĖņäØļÉśņ¢┤ Ļ▓░ĒĢ©ņ£╝ļĪ£ ņ×æņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ļ│┤ņ×ÉļĀź ņĀĆĒĢśņØś Ļ░Ćņן Ēü░ ņÜöņØĖņØ┤ ļÉ£ļŗż [29].
4. Ļ▓░ ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Nd ĻĖłņåŹņØś ņÜ®ņ£ĄņŚ╝ ņĀäĒĢ┤ ņĀ£ņĪ░, ĒŖ╣Ē׳ ļČłĒÖöļ¼╝ ņÜ®ņ£ĄņŚ╝Ļ│ä Nd ņé░ĒÖöļ¼╝ ņĀäĒĢ┤ņŚÉ ņØśĒĢ£ Nd ĻĖłņåŹ ņĀ£ņĪ░ņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢśņśĆļŗż. Ļ▓░ļĪĀņØä ņÜöņĢĮĒĢśļ®┤ ļŗżņØīĻ│╝ Ļ░Öļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ņĀäĒĢ┤ņś©ļÅä ļ▓öņ£ä, 1030~1130 ┬░CņŚÉņä£ ņĀäļźś ĒÜ©ņ£©ņØĆ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņØś ņäĖĻĖ░ņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņĀäĒĢ┤ņś©ļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ Ļ▒░ņØś ņäĀĒśĢņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ņĀäĒĢ┤ņś©ļÅäĻ░Ć 1030~1040 ┬░C ņĀĢļÅäļĪ£ ļäłļ¼┤ ļé«ņØä Ļ▓ĮņÜ░, ņĀäļźśĻ░Ć ņ×ÉņŻ╝ ļ®łņČöĻ│Ā ņĀäņĢĢņØĆ ņĀĢļźśĻĖ░ņØś ņäżņĀĢ ĒĢ£Ļ│äĻ░ÆņØä ļäśņ¢┤ ņĀäĒĢ┤Ļ░Ć ņżæļŗ©ļÉśņŚłļŗż. ļö░ļØ╝ņä£ ņĀäĒĢ┤ņś©ļÅäļŖö ņ×æņŚģņä▒ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņĀäļźś ĒÜ©ņ£©ņØś Ļ┤ĆņĀÉņŚÉņä£ 1040~1050 ┬░C ļ▓öņ£äĻ░Ć Ļ░Ćņן ņĀüņĀłĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅä ļ▓öņ£ä, ņĢĮ 1~4 A/cm2ņŚÉņä£ ņĀäļźś ĒÜ©ņ£©ņØĆ ņĀäĒĢ┤ņś©ļÅäņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā ļīĆņ▓┤ļĪ£ ņäĀĒśĢņĀüņØĖ Ļ┤ĆĻ│äļź╝ ļéśĒāĆļé┤ņŚłļŗż. Nd2O3 Ēł¼ņ×ģ ņåŹļÅäĻ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅäĻ░Ć ņĀäļźś ĒÜ©ņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źĻ│╝ ļÅÖņØ╝ĒĢ£ Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłļŗż. ņ”ē, ņĀäļźś ĒÜ©ņ£©ņØĆ Nd2O3ņØś Ēł¼ņ×ģ ņåŹļÅäņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśņśĆļŗż. ļŗżļ¦ī, Nd2O3ņØś Ēł¼ņ×ģ ņåŹļÅäļŖö ņÜ®ĒĢ┤ļÅä ļ▓öņ£ä ļé┤ņŚÉņä£ ņØĖĻ░Ć ņĀäļźśļ¤ēĻ│╝ ņāüņØæĒĢśĻ▓ī ļ│ĆĒÖöņŗ£ņ╝£ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØīĻĘ╣ ņĀäļźś ļ░ĆļÅä 3.6 A/cm2, ņĀäĒĢ┤ņś©ļÅä 1045 ┬░CņŚÉņä£ ņĀäļźś ĒÜ©ņ£© 73.6%ļź╝ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ņł£ļÅä > 99.8%ņØś Ļ▓░Ļ│╝ļź╝ ņ¢╗ņŚłļŗż.