COMSOL을 활용한 신 마그네슘 전해 공정 수치해석 모델 개발
Abstract
Magnesium (Mg) has good physical properties including light weight, excellent specific strength and high stiffness, and Mg is used in many fields. But current production methods of Mg have disadvantages, such as the generation of sulfur oxide and chlorine gas. In this situation, The Korea Institute of Geoscience and Mineral Resources (KIGAM) developed a Molten Salt Electrolysis Using Liquid Metal Cathode (MSELMC) method to produce high-purity magnesium. The MSE-LMC method can obtain 99.998-99.999% high-purity magnesium by the electrolysis of MgO dissolved in (MgF2)-LiF molten salt at 1053-1083 K, and by vacuum distilling an alloy generated by reacting with a metallic liquid cathode at 1200-1300 K. This study developed a numerical analysis model using COMSOL Multiphysics electrodeposition module to optimize the design of the electrolysis process. The model temperature was 1053K and molten salt was 54MgF2-46LiF with a 0.6wt% MgO system. 10A constant current was applied at the anode. This model uses the Butler-Volmer equation and the Nernst equation for the electric reaction. The Stokes-Einstein equation and Nernst-Einstein relation were used to calculate the diffusivity and electric mobility of salts. Unlike the experiment, in this model chlorine gas was generated. However, this model satisfied Faraday’s law. Therefore we define a new parameter using electric flux and voltage to conduct a quantitative evaluation according to the electrode shape, and compared that parameter by the changing angle of the anode.
Key words: Simulation by COMSOL, Electrolysis product, Magnesium
1. 서 론
마그네슘(Mg)은 구조재료 중 가볍고 높은 비강도 등 우수한 특성으로 다양한 분야에서 널리 사용되고 있으며 그 수요는 지속적으로 증가할 것으로 예상된다[ 1- 5]. 상용 Mg 생산 공정은 열환원법과 전기분해법으로 구분되며, 현재 세계 Mg의 약 85%는 열환원법 중 하나인 Pidgeon 공정에 의해 중국에서 생산되고 있다[ 6]. 하지만 Pidgeon 공정은 생산성이 낮고 높은 에너지 소비와 노동력이 필요하며, 공정 중 다량의 황산화물(SO x) 및 이산화탄소(CO 2) 가스가 발생하는 단점이 있다[ 7- 9]. 전기분해법은 열환원법에 비해 온실가스 발생이 적은 장점이 있지만, 음극으로 사용된 철(Fe)로 인해 생산된 Mg에 Fe가 함유되어 Mg의 내식성 감소의 원인이 되며, 전해 중 독성의 염소(Cl 2) 가스가 발생하는 단점이 있다[ 7, 10]. 이와 같은 기존 상용 Mg 생산 공정의 단점을 개선하기 위해 다양한 연구가 진행되고 있으며 그 중 한국지질자원연구원(KIGAM)에서는 산화마그네슘(MgO)을 원료로 하는 액체금속 음극을 이용한 용융염전해(Molten Salt Electrolysis using Liquid Metal Cathode, MSE-LMC)법을 개발하였다[ 11- 13]. MSE-LMC법은 MgO의 용융염 전해 시 불화마그네슘(MgF 2)-불화리튬(LiF) 용융염을 사용하여 1053-1083 K에서 MgO의 용융염전해를 통해 음극으로 사용되는 금속과 Mg의 합금을 형성하는 공정과 이를 통해 형성된 Mg 합금을 1200-1300 K에서 진공 증류를 통해 고순도 Mg 금속을 생산하는 공정으로 이루어진다. 향후 MSE-LMC법의 스케일업을 위해서는 본 공정에 대한 수치해석 모델 개발이 필수적이기 때문에 본 연구에서는 상용 다중 물리현상 해석 프로그램인 COMSOL을 이용하여 전해 공정의 수치해석 모델을 개발하였다. COMSOL은 상용 유한요소 해석 프로그램으로 단일 물리현상 뿐만 아니라 같은 형상에 여러 다중 물리현상을 해석할 수 있으며 모델을 만든 후 다른 물리현상을 추가하기에도 용이하다.
2. 모델 설명
2.1 모델 형상
모델 형상은 그림 1의 KIGAM의 실험장비를 바탕으로 그림 2로 설계하였다[ 12]. 파란색 음영부분이 전해질 영역이며 전해질 아래 영역이 음극, 화살표 모양의 콘이 양극이다. 해당 영역에서 주로 화학종의 이동을 해석하는 연속 방정식, 양 전극의 전기화학적 반응을 해석하는 Butler-Volmer방정식의 해석을 진행한다.
2.2 지배방정식
COMSOL에서 3차전류분포 물리현상을 이용하였다. 전해 공정은 전해질 영역에서 용융염 내에 존재하는 이온들이 양극과 음극으로 이동하는 물질 이동과 전극 표면에서 전하 전달에 의해 용해, 전착이 일어나는 전기화학적 반응으로 나눌 수 있다[ 14]. 화학종 j에 대한 질량 보존 식은 식 (1)과 같다.
cj는 j 화학종의 농도(mol·m-3), t는 시간(s), Jj는 j 화학종의 유속(mol·m-2·s-1), u 는 전해질의 속도(m·s-1), Rj는 j 화학종의 발생원(mol·m-3·s-1)이다.
유속은 화학종이 전해질 내에서 확산, 이동, 대류에 의해 계산되며 대류에 의한 영향은 식 (1)에 u⋅∇cj 로 포함되어 있으므로 유속은 식 (2)와 같다.
Dj 는 j 화학종의 확산계수(m2·s-1), zj 는 j 화학종의 전하수, um,j 는 j 화학종의 이동도(s·mol·kg-1), F는 패러데이 상수, ϕl 는 전해질 전위(V)이며 우변의 첫째항이 확산, 두번째 항이 전기이동에 해당한다.
이동도는 Nernst-Einstein relation을 이용해 확산계수로부터 식 (3)으로 계산한다.
R은 기체상수, T는 절대온도(K) 이다.
전해질 내에서의 전류는 이온의 이동에 의해서만 흐른다고 가정하였으며 모든 화학종의 유속을 총합을 이용해 식 (4)와 같다.
il 은 전해질 내에서의 전류밀도 벡터(A·m-2)이며 전하 보존법칙을 만족한다.
발생원이 없으므로 Rj 는 0이다. 미지수는 cj,Jj,ϕl,il 인데 식은 식 (1), (2), (4)로 식이 하나 부족하게 된다. 여기에 COMSOL에서는 전해질의 전기적 중성조건인 식 (5)을 추가하여 화학종 하나의 농도를 다른 화학종의 농도와 식 (5)을 이용해 계산한다.
전해질 내의 물질이동에 대한 지배방정식은 여기까지이며 다음은 전극 표면에서의 전기화학적 반응에 대한 지배 방정식이다.
전극 표면에서의 전기화학 반응식의 화학양론 계수는 식 (6)을 이용해 정의한다.
Sred는 환원된 화학종이며 환원반응에서의 생성물이다. SOX 는 산화된 화학종이며 환원반응에서 반응물이다. SOX, vred 는 각각 해당 화학종의 화학양론 계수이며 SOX 는 음수로 정의하여 해당 화학종이 산화된 화학종인지 환원된 화학종인지를 구분한다.
음극에서는 Mg2+와 Li+의 환원반응이 일어날 수 있으며 반응식은 식 (7), 식 (8)과 같다.
양극에서는 전극 소재인 탄소(C)와 반응하여 O2-와 F-의 산화반응이 일어날 수 있으며 반응식은 식 (9), 식 (10)과 같다.
각각의 반응식을 식 (6)에 대입하여 화학양론 계수와 반응에 참여하는 전자수가 결정된다.
전극과 전해질 계면에 수직방향인 j 화학종의 몰 유속 (Nj, mol·m-2·s-1)은 식 (11)과 같이 모든 전극반응에서 생성되는 유속의 합으로 계산한다.
iloc, m 은 m 전극반응의 local current density이며 농도 의존성 Butler-Volmer 방정식에 의해 식 (12)로 계산된다[ 15].
i0 는 exchange current density이며 αa(αc) 는 전달 상수, η 는 활성화과전위이다.
교환전류 i0 에 농도에 대한 항이 들어가며 식 (13)과 같다[ 14].
i0, ref 는 reference exchange current density이다.
ϕs 는 전극 전위, Eeq 는 평형포텐셜이며 평형포텐셜은 Nernst 방정식을 이용해 식 (15)으로 계산한다.
2.3 경계 및 초기조건
표 1은 모델에서 사용된 경계조건과 초기조건이다.
전해질 내에서의 각 이온의 확산 계수는 Stokes-Einstein 방정식을 이용하여 식 (16)으로 계산하였다[ 16]. 이때, 점성계수 η 는 1070 K의 32.8MgF 2 − 67.2LiF + 0.6 wt% MgO 용액의 값을 사용하였고 반지름 r은 각 이온의 반지름을 사용하였다 [ 17]. 각 반응의 평형 포텐셜과 전달 상수는 그림 3의 C-Mo 전극의 순환전압전류법의 결과를 참조하였다 [ 11]. 전달 상수와 reference exchange current density는 순환전압전류법의 그래프와 Butler-Volmer 식인 식 17, 18을 gnuplot프로그램을 사용하여 최소제곱법으로 fitting 하여 구하였다.
그림 4~ 6 은 그림 3 의 각각의 반응이 시작하는 지점 근처와 fitting 한 Butler-Volmer 식의 그래프이다.
순환전압전류법의 결과를 봤을 때, 전압이 부족하여 Li 이 반응하지 않았으므로 Li 환원 반응의 전달 상수와 reference exchange current density는 Mg 환원 반응의 값을 그대로 사용하였다.
전기적 경계조건은 정전류로 10A를 설정하였다.
3. 결과 및 분석
COMSOL 모델 해석 결과와 실제 실험 결과와 비교해보면 실제 실험에서는 불소기체가 발생하지 않았지만, 그림 7의 모델 해석 결과에서는 13초 경과 후 불소기체가 발생하며 전위차가 급격히 상승하는 것을 볼 수 있다. 해석 결과와 실험 결과가 다른 이유로는 모델에서는 양극 표면의 산소기체 발생에 따른 용융염의 유동이 포함되어 있지 않기 때문에 산화전극 표면에서의 산소 이온의 고갈됨에 따라 불소기체가 발생했다고 예상된다.
이처럼 모델 해석 결과와 실제 실험 결과가 일치성을 보이진 않지만, 그림 8에서 모델 해석 결과와 KIGAM에서 진행한 Scale-up결과가 패러데이의 법칙의 선위에 존재하므로 패러데이의 법칙을 만족한다. 따라서 전극 형상 최적화에 사용하기 위해 본 모델의 정전기적 해석 결과를 이용하여 새로운 매개변수를 정의하였다. Characteristic length(L, m)은 전해질의 유전율을 진공이라 가정하고 0초에서의 산화전극 표면의 전기선속을 전위차로 나눠준 값으로 정의하였다.
그림 9에서 양극의 부피를 같게 두고 형상의 θ 값을 변화시켜가며 L 값을 계산하였으며 θ가 작을수록 L값이 증가한다. L값이 크다는 것은 같은 전기선속을 만들어내는데 필요한 전위차가 더 적다는 것을 의미하며 이는 즉, 같은 전류가 흐를 때, 더 적은 전위차가 걸리게 된다는 뜻이다. 따라서 L값이 클수록 에너지 효율이 더 좋을 것으로 판단되며, 표 2 처럼 결국 30-60도까지 10도 단위로 분석을 해본 결과 30도의 경사각을 가질 때 가장 제련 장비의 효율이 우수할 것으로 판단할 수 있었다.
4. 결 론
Mg 전해공정의 모사하기 위한 수치해석 모델을 개발하였으며 제련장비의 전극의 경사각에 따른 효율을 비교하기 위해 characteristic length을 도입하였다. 비록 유동 효과를 고려하지 않은 한계점은 존재하지만, 해석 결과는 패러데이 법칙을 만족하였으며 경사각 30-60도 범위 내에서는 각도가 작아질수록 characteristic length가 증가한다는 것을 확인하였고, 이는 제련 시스템의 효율이 증가하는 것으로 해석하였다. 모델과 실험의 일치성은 산소기체 발생에 따른 유동을 포함하여 액체와 기체의 2상 유동 해석을 적용하면 높일 수 있을 것이라 판단되나, 2상 유동 해석의 경우 수렴성이 현저히 떨어지는 한계가 존재하며 이 부분에 대해서는 유동현상 모사를 위한 더 수준 높은 수치해석 모델의 개발이 필요할 것으로 판단된다.
Acknowledgments
본 연구는 2022년도 정부(산업통상자원부)의 재원으로 사용후핵연료관리핵심기술개발사업단 및 한국에너지기술평가원의 지원을 받아 수행된 연구사업이다(과제번호: 2021040101003C).
Fig. 1.
(a) Dimensions of the cell used in this study and photographs of the (b) bottom and (c) top view of the alumina crucible and (d) graphite anode. 
Fig. 2.
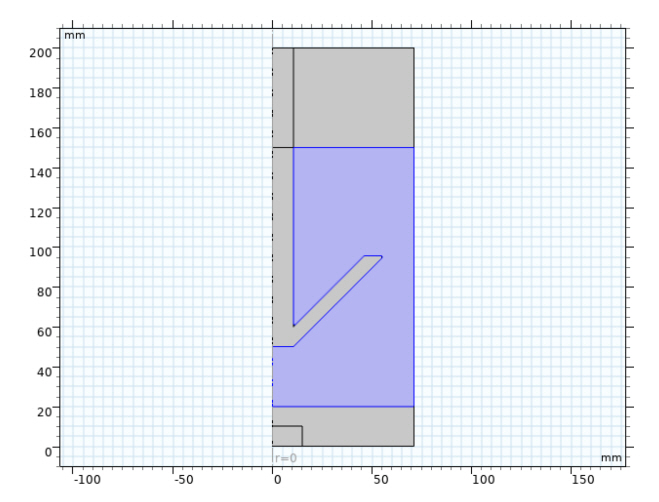
Fig. 3.
Result of CV measurement of the addition of MgO in MgF2-LiF molten salt after pre-electrolysis using a graphite anode with respect to the Pt quasi-reference electrode at 1083 K. 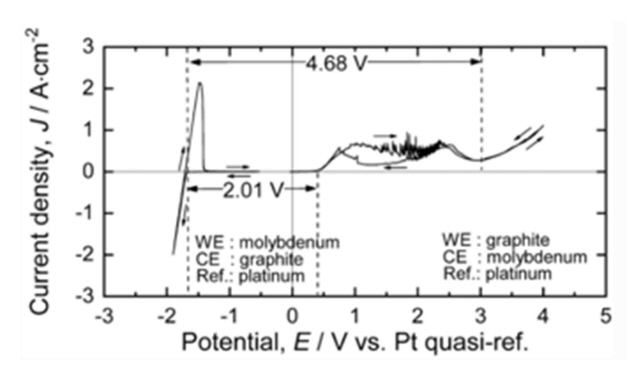
Fig. 4.
Butler-Volmer fitting curve and CV measurement data of Mg reduction reaction. 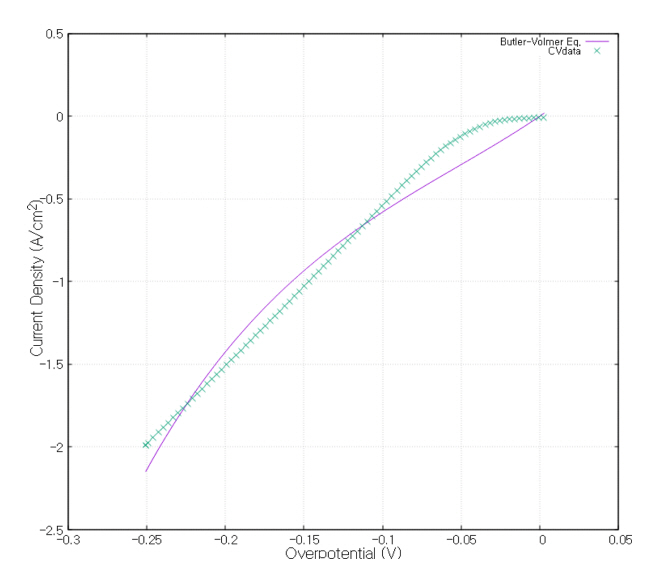
Fig. 5.
Butler-Volmer fitting curve and CV measurement data of CO2 oxidation reaction. 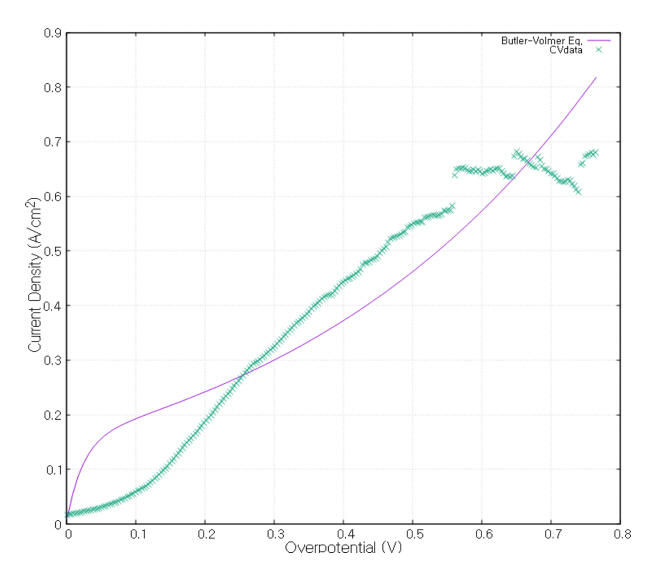
Fig. 6.
Butler-Volmer fitting curve and CV measurement data of F2 oxidation reaction. 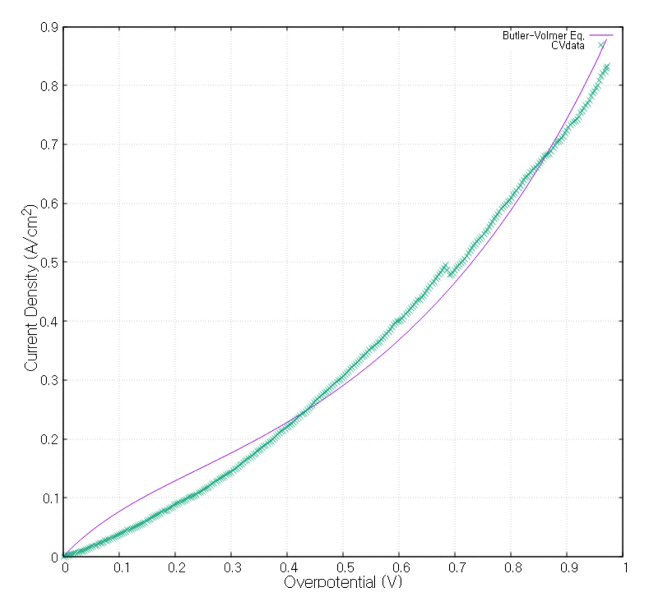
Fig. 7.
External electric potential-Time curve. 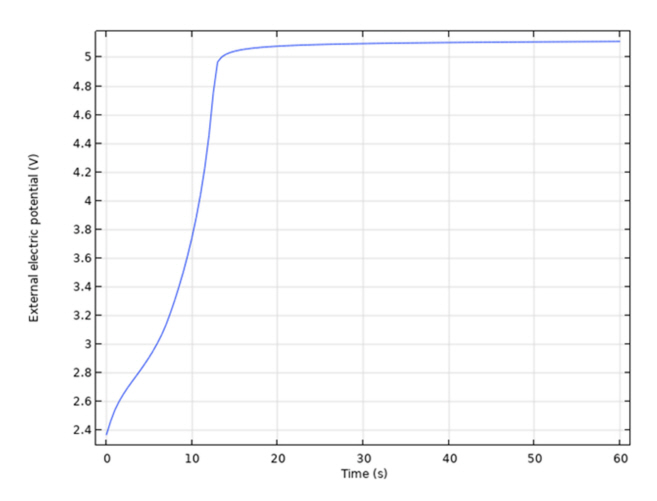
Fig. 8.
Mg deposition weight result with faraday curve 
Fig. 9.
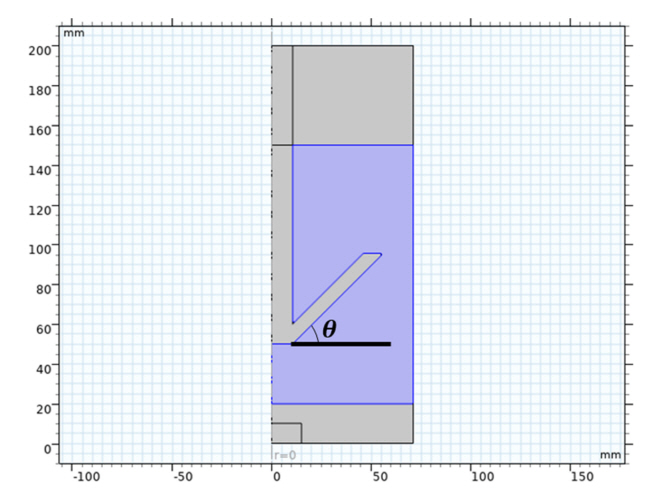
Table 1.
Parameters and boundary conditions
|
Parameters |
Expressions and Unit |
Value |
|
Temperature |
T(K) |
1053 |
|
Diffusivity of Mg2+
|
DMg2+ (m2·s-1) |
4.928 × 10-10
|
|
Diffusivity of Li+
|
DLi+ (m2·s-1) |
4.709 × 10-10
|
|
Diffusivity of O2-
|
DO2– (m2·s-1) |
3.363 × 10-10
|
|
Diffusivity of F-
|
DF– (m2·s-1) |
3.561 × 10-10
|
|
Reference Concentration |
cj, ref
|
54MgF2 — 46LiF + 0.6 wt% MgO |
|
Reference Equilibrium Potential of Mg(s) |
Eeq, ref,Mg (V) |
-1.65 |
|
Reference Equilibrium Potential of Li(s) |
Eeq, ref, Li (V) |
-2.088 |
|
Reference Equilibrium Potential of CO2(g) |
Eeq, ref, CO2 (V) |
0.36 |
|
Reference Equilibrium Potential of F2(g) |
Eeq, ref, F2 (V) |
3.03 |
|
1)Reference Exchange Current Density of Mg(s) |
i0, ref, Mg (A·m-2) |
2948.2 |
|
1)Reference Exchange Current Density of Li(s) |
i0, ref, Li (A·m-2) |
2948.2 |
|
1)Reference Exchange Current Density of CO2(g) |
i0, ref, CO2 (A·m-2) |
1569.9 |
|
1)Reference Exchange Current Density of F2(g) |
i0, ref, F2 (A·m-2) |
904.43 |
|
1)Anodic Transfer Coefficient of Mg(s) |
aa, Mg
|
1.2791 |
|
1)Anodic Transfer Coefficient of Li(s) |
aa, Li
|
0.5 |
|
1)Anodic Transfer Coefficient of CO2(g) |
aa, CO2
|
0.19589 |
|
1)Anodic Transfer Coefficient of F2(g) |
aa, F2
|
0.21245 |
Table 2.
Characteristic length with angle
|
θ
|
30° |
40° |
50° |
60° |
|
L(m) |
0.7736 |
0.6618 |
0.5800 |
0.5143 |
REFERENCES
1. J. Go, J. U. Lee, B. G. Moon, J. Yoon, and S. H. Park, Met. Mater. Int. 26, 1779 (2020).   2. K. S. Choi, J. H. Hwang, K. Lee, and K. S. Shin, Korean J. Met. Mater. 53, 569 (2015).  3. U.-H. Baek, B. D. Lee, K. W. Lee, G. S. Han, and J. W. Han, Korean J. Met. Mater. 54, 104 (2016).  5. D.-G. Lee, J.-B. Kwon, H.-J. Lee, S.-M. Jo, Y.-M. Rhyim, W.-J. Yang, and Y.-D. Kim, Korean J. Met. Mater. 57, 279 (2019).   6. Y. Wada, S. Fujii, E. Suzuki, M. M. Maitani, S. Tsubaki, S. Chonan, M. Fukui, and N. Inazu, Sci. Rep. 7, 46512 (2017).
7. H. E. Friedrich and B. L. Mordike, Magnesium Technology Metallurgy, Design data, application, pp. 52–60, Springer, Berlin (2006).
8. J. Du, W. Han, and Y. Peng, J. Clean. Prod. 18, 112 (2010).  9. S. Ramakrishnan and P. Koltun, RCR. 42, 49 (2004).  10. G. J. Kipouros and D. R. Sadoway, Advanced Molten Salt Chemistry, pp. 127–209, Elsevier, Amsterdam (1987).
11. T.-H. Lee, T. H. Okabe, J.-Y. Lee, Y. M. Kim, and J. Kang, Metall. Mater. Trans. B. 51, 2993 (2020).   12. D.-H. Lee, H.-J. Jeoung, T.-H. Lee, K.-W. Yi, J.-Y. Lee, Y. M. Kim, T. H. Okabe, and J. Kang, J. Sustain. Metall. 7, 883 (2021).   13. T.-H. Lee, H. Park, J.-Y. Lee, Y. M. Kim, and J. Kang, Korean J. Met. Mater. 59, 392 (2021).   15. R. Guidelli, R. G. Compton, J. M. Feliu, E. Gileadi, J. Lipkowski, W. Schmickler, and S. Trasatti, Pure Appl. Chem. 86, 245 (2014).  16. A. Einstein, Annalen der Physik. 322, 549 (1905).  17. Y. Kim and J. Kang, J. Non-Cryst. Solids. 522, 120377 (2021).
18. Hyeong-Jun Jeoung, Tae-Hyuk Lee, Youngjae Kim, JinYoung Lee, Young Min Kim, Toru H. Okabe, Kyung-Woo Yi, and Jungshin Kang, J. Magnes. Alloy. 11, 562 (2023).
19. H.-J. Jeoung, Y. Kim, T.-H. Lee, J.-Y. Lee, Y. M. Kim, K.-W. Yi, and J. Kang, J. Appl. Electrochem. 52, 1535 (2022).   20. T.-H. Lee, T. H. Okabe, J.-Y. Lee, Y. M. Kim, and J. Kang, J. Magnes. Alloy. 9, 1644 (2021). 
|
|




















