질소 5N 가스 분위기에서 다공질 ZrFe 합금의 산화 안정화
Oxidation Stabilization of ZrFe Alloys in Nitrogen Gas Atmosphere
Article information
Trans Abstract
A porous ZrFe alloy specimen was prepared as a 6 × 3 mm (diameter × thickness) disk. The reaction of the ZrFe alloy was confirmed while the whole system was maintained at a target temperature, which was increased from 150 °C to 950 °C in a 99.999% low purity nitrogen atmosphere, consisting of 10 ppm of impurity gas. Surface color, pore size, stabilized layer, and phase change were confirmed with optical microscopy, scanning electron microscopy-energy dispersive X-ray spectroscopy, X-ray diffraction, X-ray photoelectron spectroscopy, and Micro-Raman, according to temperature. The surface color of the ZrFe alloy changed from metallic silver to dark gray as the temperature increased. In the EDS and XPS results, nitrogen component was not observed, and oxygen content increased on each surface at the elevated temperatures. In this way, the ZrFe alloy was stabilized in a low purity nitrogen atmosphere, preventing rapid nitride reactions.
1. 서 론
Zr계 합금은 최근 디스플레이 및 반도체 산업 분야와 일반 산업용 초고순도 가스 정제 분야에서 크게 수요가 증가하고 있다. 디스플레이 분야에서는 디스플레이 부품의 초고진공을 만드는 진공용 게터 소재로써 사용되며, 반도체 산업 및 일반 산업에서는 공정시 사용하는 초고순도 가스를 제작하기 위해서 불순물을 제거하기 위해 사용된다 [1]. 이중 석유화학산업 분야와 반도체 공정 분야에서는 5N급 불활성 질소 가스의 수요가 크기 때문에 목적하는 정제 가스의 순도 요구에 따라 게터성능이 최적화된 다양한 Zr계 합금을 사용한다.
게터란 화학적으로 활성화된 금속 물질의 고유한 특성에 의해 특정 기체가 게터 금속과 화학 흡착하여 진공 환경 또는 고순도 기체를 만들 수 있는 물질이며, 물리화학적 특성에 따라 증발형 게터(evaporable getter)와 비증발형 게터(non-evaporable getter)로 분류 된다. 증발형 게터는 고온의 활성화 단계에서 게터의 금속 물질 자체가 증발 및 확산되어 기체와 흡착하는 게터로 증발이 쉬운 마그네슘, 바륨 등이 포함된 합금을 사용하며, 음극선관(cathode ray tube) 또는 램프 내부의 진공 조성 물질로 이용된다. 증발형 게터를 사용하는 경우 게터 물질 자체가 증발되어 결국 소자를 오염시킬 수 있으므로 최근 사용이 줄고 있는 추세이다 [2].
비증발형 게터는 벌크형태의 활성이 큰 Zr을 포함한 다공성의 반응성 금속합금체를 사용하여 제작하며, 300~400 °C 정도의 적절한 구동온도에서 활성화 공정을 거쳐 N2가스 내의 불순물을 선택적으로 제거할 수 있어서 최근 건축용 단열창호재료, 석유화학분야, 그리고 반도체 산업 등의 일반 산업용 초고순도 질소가스 정제 분야에 주로 활용되고 있다 [3].
일반 산업용 초고순도인 5N급 질소가스 정제용 비증발형 게터의 제조는 주로 활성화 에너지가 작은 Zr, Fe, V, Ti, Mn, Al, Zn 등의 금속을 조합하여 특정 조성의 주괴를 형성하고, 용해된 시편을 수소화-탈수소법으로 분말화하여 펠렛(pellet) 형태로 성형하여 활용한다 [4]. 이때 게터 효율을 증가시키기 위해 열린 기공으로 적절한 기공크기와 기공율을 갖는 다공성이 되도록 한다.
또한 반도체 공정용 질소가스는 9N급의 초고순도를 필요로 하기 때문에 가스 정제를 위해서 일반 산업용 정제 방법과 동일하게 단계별로 여러 가지 Zr계 합금 게터를 이용하여 불순물을 제거하는 것으로 알려져 있다 [5,6].
일반 산업용 N2 가스 정제용 게터의 구성요소로는 주로 Zr을 채용하고 합금원소로 Fe, V, Ti, Mn, Al, Zn 등이 활용되고 있으나, 이중 ZrFeX 합금 게터효율에 관한 연구가 활발한 것으로 알려져 있다 [5].
특히 본 연구에서 ZrFe(Zr-28wt% Fe)는 Zr60Fe40의 ZrFe2와 Zr2Fe로 구성된 규칙상의 혼합상으로 약 1350 °C의 융점을 가지고 활성이 용이하며, 350~400 °C 정도의 활성화 온도를 갖는 특징이 있다 [7,8,9].
그러나, N2 가스에서도 2ZrFe+N2→ 2ZrFeN과 같이 반응하므로 ZrFe가 쉽게 각각 질화물을 형성하여, 이때 다공성 시료의 표면부부터 발열반응을 일으키고 연속적인 질화 반응을 일으켜 폭발을 일으키는 문제가 가능하다.
Zr-N과 Fe-N 이원계상태도 [10]에 의하면, 약 400 °C의 N2 분위기에 노출된 a-Zr은 게터운용 중에 20 at% N을 함유하다가 더 이상 사용하게 되면 급격히 ZrN화합물을 형성시킨다. 마찬가지로 Fe의 경우도 Fe4N, Fe2N, FeN 둥 다양한 질화중간상을 형성시켜 문제를 일으킬 수 있다.
실제 9N 급의 N2가스를 20 ccm 이상의 양을 400 °C로 가스 정제를 실시할 경우 ZrN, FeN이 생성되며 각각 ΔH=-365.26 KJ/mol, ΔH = -47.08 KJ/mol 의 큰 발열반응을 유발하게 된다 [11,12]. 이러한 상황이 계속되면 열이 누적되어 게터자체 뿐 아니라 정제용 게터를 담지하고 있는 금속용기도 충분히 녹일 수 있는 2000 °C 이상의 발열이 가능하여 폭발이 일어날 수도 있다.
일반 산업적용도의 5N급 N2의 정제상황 시 이미 10 ppm 이상의 O2 불순물이 있다면 Zr 산화 반응에서 ΔH = -1080.0 KJ/mol의 발열반응이 나타난다. Fe의 경우, 산소의 비율에 따라 FeO, Fe2O3, Fe3O4 등의 3가지 상태로 존재할 수 있으며, 이들은 각각 ΔH = -272.0 KJ/mol, ΔH = -1115.7 KJ/mol, ΔH = -826.2 KJ/mol의 큰 발열 반응이 나타날 수 있다. 이 때문에 발생되는 주어진 순도의 N2 환경에서 ZrFe 게터 합금의 활성화 온도가 올라감에 따라 어떤 원소와 우선적으로 반응하는지와 이때의 발열 안전성에 대한 연구는 진행되지 않았다 [11,12].
따라서, 본 연구는 ZrFe 게터에 대해 99.999% (5N) 일반산업용 초고순도 N2의 정제공정을 가정하고, 150~950 °C까지 변화시킨 범위에서 온도별로 급격한 질화반응의 방지가 가능한지 확인하였다.
2. 실험 방법
본 연구에서는 각 열처리 온도에 따른 ZrFe 합금의 안정화 정도를 확인하기 위해 Zr6Fe4(30wt% Fe)의 비증발성 게터용 시료를 준비하였다.
Fig 1에는 ZrFe 다공체의 광학현미경 이미지를 나타내었다. 시편 한 개의 무게는 0.460 g이였으며, 두께는 3 mm, 직경은 6 mm로 확인되었다. 표면에는 육안으로 확인이 가능한 다수의 기공이 존재하였다.
기공의 정량 평가를 위해서 수은 측정 방법(Auto Pore IV 9500, micromeritics co.)을 이용하여 0.2 psia에서 분석하였으며, 시료 표면에 액상 방울을 떨어뜨려 즉시 시료 안으로 흡수되는 droplet 테스트를 이용하여 이 다공체가 열린 기공으로 구성됨을 확인하였다.
N2 분위기에서의 온도별 다공체 활성화 실험은 Fig 2과 같이 준비된 각 ZrFe 다공체를 튜브 퍼니스(C-A14P, Hantech)를 이용하여 목표온도에 도달시키고, N2(99.999%) 가스 유량은 MFC(VIC-D210, MKP)를 이용하여 40 sccm으로 조절하였다. 이때 제작한 시편과 알루미나 도가니 사이의 접촉을 방지하기 위해 Al2O3 분말을 도포한 후 준비된 시편을 N2 분위기에서 각각 150 °C~950 °C 온도에서 유지하였다. 이때 안정 전처리 열처리 공정은 2 °C/min. 승온속도로 목표온도까지 승온시켜 10분 동안 유지한 후 1 °C/min. 냉각속도로 냉각시켰다.
열처리 전과 후의 매크로 형상 변화는 저배율 광학현미경(815000, GIA instrument Co., AX-10, ZEISS)을 이용하여 10~200 배율로 관찰하였다.
시편의 미세구조를 확인하기 위해 시료 표면부를 주사전자현미경(FE-SEM, S-4300, Hitachi)을 이용하여 확인하였다. 또한 원소별 분포를 확인하기 위해 EDS(EDS, JSM-6010PLUS/LA, JEOL)를 이용하였다.
시편의 물성을 확인하기 위해 X-선 회절분석(XRD, Smartlab, Rigaku Co.)을 이용하였다. X선 source는 9 kW x-ray generator를 이용한 CuKα이고, tube current는 200 mA, voltage은 45 kV이었다. 이때 스캔 범위는 20~90 ° 범위로, 스캔 스텝은 0.02 °로 측정하였다.
시편의 산화물과 질화물의 생성을 확인하기 위해 X-선 광전자 분광법(XPS, Nexsa, Thermofisher)을 이용하였다. X선 source는 AlKα이고, spot size는 400 um, energy step은 0.1 eV로 분석하였다.
표면에 형성된 박막의 물성을 확인하기 위해 MicroRaman 분광기(UniRaman, Unithink Co.)를 통해 분석을 진행하였다. 이때 각 시료에 대해 센터값 1200 cm-1로 반복(accumulation) 모드를 사용하여 노출값 10초, 60회의 스캔을 진행하여 300~2000 cm-1범위에 대해 특성피크를 확인하였다.
3. 실험 결과
Fig 3에는 ZrFe 다공체의 열처리에 따른 광학현미경 미세구조를 나타내었다. 우상단에는 시료의 매크로 이미지를 나타내었다. (a) 열처리 하지 않은 ZrFe 다공체, (b) 150 °C, (c) 350 °C, (d) 550 °C, (e) 750 °C, (f) 950 °C의 각 온도에서 열처리한 ZrFe 다공체이다.

Macro images of ZrFe with elevated temperature of (a) as prepared, (b) 150 °C, (c) 350 °C, (d) 550 °C, (e) 750 °C, (f) 950 °C.
100배 확대하여 측정한 게터들의 직경의 크기 변화, 내부 기공과 결정립 크기의 변화는 없었으며, 우상단에 나타낸 매크로 이미지에서는 열처리 온도에 따른 색변화를 확인할 수 있었다. (a)와 (b)는 유사한 색으로 확인되었으며, (c)부터 표면색이 브라운색으로 변화하였으며, (d) 550 °C부터 표면색이 검은색으로 나타났다. 이후 (e), (f)와 같이 온도가 올라갈수록 색이 진해지는 것을 확인했다. 질화물이 생성될 경우 ZrFe의 표면색은 황금색으로 보인다는 보고 [13]에 근거하여, 이는 표면에 ZrFe 산화반응물이 형성되어 나타난 현상으로 판단하였다.
Fig 4에는 SEM으로 분석한 미세구조 결과를 나타내었다. (a)의 열처리 전 이미지에서는 작게는 5 μm에서 크게는 25 μm 정도의 다양한 기공이 분포하고 있는 것을 확인할 수 있었다. 이는 앞서 확인한 광학현미경 이미지와 일치하는 결과였다. 이후 (b)~(f)에 나타낸 150 °C에서 950 °C까지의 ZrFe 게터의 미세구조는 앞서 보인 (a)와 큰 차이가 없었다. 이러한 결과는 광학현미경에서 확인한 색 변화가 미세구조 차이로 인해 나타난 결과가 아니라 표면에 생성된 박막으로 인해 나타난 것으로 판단하였다. 또한 형성된 박막이 기존의 형성되어 있던 기공의 크기나 기공률에는 영향을 미치지 않고, 표면에만 형성된 것을 확인할 수 있었다.

SEM images of ZrFe with elevated temperature of (a) as prepared, (b) 150 °C, (c) 350 °C, (d) 550 °C, (e) 750 °C, (f) 950 °C.
또한 수은 분석법으로 ref 시편과 550 °C 열처리 시편에 대한 평균기공크기와 기공률을 확인한 결과 각각 974 nm, 11.8%와 1,330 nm, 13.8%로 확인되었다. 각 SEM 이미지에서의 기공률을 검은색 기공 면적/전체면적으로 추정하면 모든 시편은 열처리 조건에 관계없이 평균 기공율 약 12%를 보여 수은법의 기공율 결과와 잘 일치하였다.
Fig 5에는 EDS 분석 결과를 그래프로 나타내었다. EDS 결과에 의하면 열처리 온도가 증가함에 따라 O의 양이 증가하는 것을 확인할 수 있었으며, 이때 N원소는 확인되지 않았다. 이는 질소 환경에서 열처리하였음에도 불구하고, 표면에 산화가 진행된 결과였다.
열처리 전 시편과 150 °C 열처리 시편까지는 Zr, Fe의 비율이 유사하게 검출되었다. 산소를 제외하면 Zr6Fe4 정도로 원래 목표한 조성의 ZrFe 시료가 준비되었음을 확인하였다. 250 °C 열처리 시편부터 450 °C 열처리의 경우, Zr과 Fe가 급격하게 감소하고 O가 급격하게 증가하는 것으로 확인되었는데, 이는 ZrFe 합금이 250~450 °C 부분에 활성화 온도가 존재하여 내부로 흡착되는 산소보다 활성화되어 산화물로 성장하는 산소가 더 많아 질소보다 우선 반응하여 나타난 결과였다.
이후 550 °C 열처리 시편에서는 Zr, Fe, O 비율이 ZrO2와 FeOx로 유사하게 유지되는 것을 확인할 수 있었다. 750 °C 이상의 고온처리에서는 Zr의 산화비율이 Fe보다 증가하는 특징을 보였다.
Fig 6은 열처리하지 전의 기준 시편과 열처리 후 시료의 XRD 결과이다. 열처리 전 시편과 350 °C 열처리 시편까지는 모두 C, Zr2Fe, ZrFe2가 공존하고 있는 것으로 확인되었다. 이는 앞선 EDS 결과에서 Zr과 Fe가 나온 것과 일치하는 결과였다. 그러나 앞서 광학현미경 및 EDS 결과에서 150 °C 이상 열처리 시편부터 확인된 O와 관련된 피크는 확인되지 않았다. 이는 저온 열처리 즉, 150 °C, 350 °C 열처리에서는 육안으로 분석이 가능한 산화막이 형성되지만, 결정성이 낮아서 XRD 분석으로는 확인할 수 없는 정도임을 의미한다.

XRD result of ZrFe alloy with elevated temperature of as prepared, 150 °C, 350 °C, 550 °C, 750 °C, and 950 °C.
이후 450 °C 이상의 열처리 시편에서는 명확하게 피크가 변화하여 ZrO2, Fe2O3, Fe3O4가 형성되고, 온도가 올라갈수록 피크가 강하게 나타나는 것을 확인할 수 있었다. 이는 열처리 온도가 증가함에 따라 형성되는 산화막 두께가 증가하여 나타난 현상으로 판단하였다. 산화막의 증가에 따라 하부의 Zr2Fe, ZrFe2 피크는 점차 보이지 않았다.
또한 550 °C 이상 열처리 시편에서는 Fe2O3, ZrO2 특성 피크가 점차 증가하는 것으로 확인되었는데, 이는 고온으로 갈수록 산화막의 증가하면서 나타난 현상으로 판단하였다. 이러한 산화막의 두께 증가는 앞서 확인한 광학이미지 결과와도 일치하는 결과였다. 특히 750 °C 열처리 이후에는 카본 피크가 사라지는데, 이는 750 °C 이상의 고온 처리로 잔류 카본 제거가 가능함을 의미하였다.
Fig 7에는 1300 eV 까지의 원소별 XPS 결과를 나타내었다. 전체 시료 모두 Zr, Fe 원소외에 C, O 원소의 존재를 보이고 있다. 550 °C 이상 열처리한 시편에서는 O1s 피크의 증가와 C1s 피크의 감소현상을 확인하였다. 특히 N의 존재는 392~408 eV 구간에서 N1s 피크에 존재로 확인할 수 있는데, 그림에 회색박스로 표시한 영역과 같이 전혀 보이지 않고 있어 비록 5N 질소 분위기에서 열처리를 하였으나 모든 시료가 표면부에 질화물을 형성하지 않았음을 의미하였다 [14,15]. 이는 앞서 보인 EDS, XRD에서 질소의 성분을 확인할 수 없었던 결과와 일치하며, XPS의 질소에 대한 분해능을 고려하면 신뢰성 있게 열처리에 따라 표면부에 질화물이 형성되지 않았음을 나타내었다.
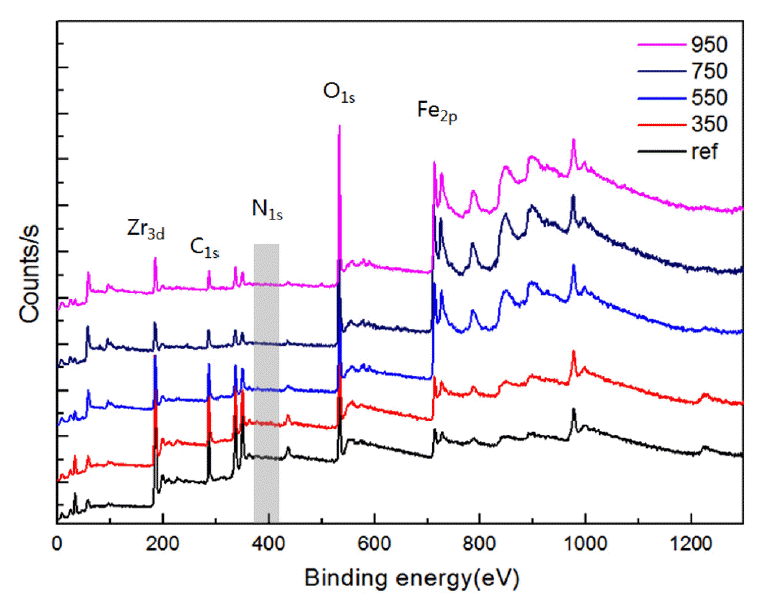
XPS result of ZrFe alloy with elevated temperature of as prepared, 350 °C, 550 °C, 750 °C, and 950 °C.
따라서, 질소 분위기에서 열처리한 시편은 질화 반응을 하지 않고, 모두 산화 반응을 한 것을 확인하였다.
Fig 8에는 micro-Raman 결과를 나타내었다. 열처리 전 시편에서는 C의 고유 피크인 D, G 피크만 확인되고, 다른 특성 피크는 확인할 수 없었다. 이러한 결과는 ZrFe 합금이 금속결합을 하여 나타난 결과였다. 이후 350 °C 열처리 시편의 경우, 앞선 XRD에서 확인되지 않았던 Fe3O4의 특성 피크가 보였고, 이는 앞서 보인 광학현미경 이미지에서 확인된 표면의 색변화 원인이 Fe3O4의 형성과 관련됨을 의미한다. 또한 XRD에서 확인되지 않은 이유는 350 °C에서 형성된 Fe3O4가 너무 얇거나 비정질로 형성되기 때문이라고 예상되었다. 또한 열처리 전에 확인되었던 C의 고유 피크인 D, G 피크가 증가하였는데, 이는 ZrFe가 활성화 되면서 공급되는 질소가스에 포함된 카본계 불순물과 반응하여 나타난 현상으로 판단하였다.

Raman spectra of ZrFe alloy with elevated temperature of as prepared, 150 °C, 350 °C, 550 °C, 750 °C, and 950 °C.
550 °C 열처리 경우, 온도 증가에 따라 Fe3O4 피크가 증가하였고, 이는 XRD에서 확인한 결과와도 일치하였다. 한편 C 피크도 증가하였는데, 이는 이미 활성화된 ZrFe 합금에서 카본계 불순물이 계속 흡착되기 때문이다 [16].
이후 750 °C 이상의 열처리한 시편의 경우, Fe3O4 피크가 명확하게 나타났으며, C의 피크는 감소하는 것을 확인하였다. 이러한 결과는 XRD 결과와 일치하는 결과로 표면 C를 제거하기 위해서는 750 °C 이상의 열처리가 필요한 것을 확인하였다. 잔류 C는 초고순도 정제 가스에서 ppm 단위로 매우 작은 양이 혼입되더라도 반도체 공정의 플라즈마 에칭이나 증착공정에서 그래핀과 같은 도전성 미세 불순물을 생성하여 치명적인 공정 결함으로 작용할 수 있으므로 적극적인 제거가 필요한데 게터의 열처리로 제거가 가능함을 의미한다.
또한 950 °C 고온에서는 Fe3O4 피크가 감소하는 것을 확인하였는데, 이는 앞선 EDS, XRD, XPS에서 확인한 바와 같이 ZrO2가 상대적으로 더 많이 형성되면서 나타난 결과이다.
이와 같이 5N 급 N2에 노출된 ZrFe 다공체는 전체 활성화 온도 범위에서 질화보다는 N2 gas에 포함된 산소계 불순물에 의해 먼저 산화되어 급격한 질화 반응이 방지되고 우선산화 안정화가 진행됨을 확인하였다.
그러나 이러한 우선산화는 결국 질소 가스정제 효과를 떨어뜨릴 수 있으므로 게터 효과를 활성화시키기 위해서는 고순도 불활성가스 분위기에서 적정한 온도구간에서 전처리를 하여 표면부의 산화층을 내부로 확산이동 시키는 새로운 활성화공정이 필요함을 의미하였다.
4. 결 론
5N 급 질소 분위기에서 다공성 Zr6Fe4 합금에 대해서 150~950 °C 온도별로 열처리한 결과, 전 온도범위에서 합금 표면은 질화물이 아닌 산화물로 안정화되었다. 미세구조 분석 결과, 열처리 온도 상승에 따라 표면에 산화박막이 성장되면서 색변화가 발생했으나, 산화박막은 기공크기와 같은 매크로 다공성 구조에는 영향을 미치지 못했다. EDS 결과 350 °C의 활성화 온도를 보이고 온도가 증가하면서 질화물의 생성 없이 ZrO2, FeOx의 성장을 보였다. XRD, XPS, Raman 분석결과 온도가 증가함에 따라 전 범위에서 질화물의 생성 없이 ZrO2, Fe3O4/Fe2O3가 점차 증가하며 안정화되고, 750 °C 이상에서는 표면부의 C를 제거할 수 있었다.


