유가금속 회수를 위한 고로 슬러지의 분산 거동
Dispersion Behavior of Blast Furnace Sludge for Valuable Metal Recovery
Article information
Trans Abstract
Blast furnace sludge, which comes from the iron making process, contains many valuable materials including iron, carbon, and zinc, etc. Because a cohesive agent is added during filtration, fine sludge particles are agglomerated together. Therefore, This makes it necessary to disperse the sludge in solution before separating or recovering valuable materials. In this study, the effects of solid/liquid (g/L) ratio, ultrasonic dispersion conditions, the pH of solvent, and the concentration of dispersant on the dispersion of sludge were investigated by measuring the interfacial properties (zeta potential and hydrodynamic size) of sludge particles. High absolute value of zeta potential and small hydrodynamic size suggests that the sludge particles in the solution presents good dispersion. The absolute value of zeta potential increased gradually at high solid/liquid ratio and ultrasonic dispersion intensity. But when the sludge in solution was dispersed for more than 30 minutes, the absolute value of the zeta potential decreased due to increasing contact and interaction between the particles. Optimal dispersion operations were conducted and when the pH of the solution was adjusted to 11, the zeta potential value was measured to be -44.8 mV. This means that the sludge formed the most stable dispersed phase. The lowest zeta potential was measured to be -46.4 mV with the addition of sodium hexametaphosphate (NaPO3)6 in the solution. It is thought that the sodium hexametaphosphate reduced ionic strength by removing alkali metal ions from the solution of sludge.
1. 서 론
일관 제철소에서의 철강 생산 프로세스는 고로(BF, blast furnace), 예비처리, 전로(BOF, basic oxygen furnace), 2차 정련, 압연 등으로 구성되어 있다 [1]. 이러한 프로세스에서 발생하는 가스 중에 함유된 더스트(dust)나 압연시에 발생하는 밀스케일(mill scale)에는 산화철, 탄소, 아연 등의 유가 성분들이 함유되어 있다. 일관 제철소에서의 더스트, 밀스케일, 슬러지를 포함하는 제철 분진의 발생량은 조강 생산량의 약 10% 정도로 알려져 있으며 [2], 그림 1에는 제철소에서 발생하는 더스트의 흐름도를 모식적으로 나타내었다 [3].
이러한 더스트의 대부분은 소결이나 콜드 펠릿(cold pellet) 등의 원료로 재이용하여 왔으며, 일부는 매립하거나 시멘트의 가철제 등으로 판매하여 왔다. 한편 더스트 중에는 소량의 Zn가 함유되어 있으며, 고로에 장입되는 전체 아연량이 증가하면 고로 내에서 아연의 부착물이 생성되어 고로 조업에 지장을 초래한다. 철광석 중의 아연 농도는 매우 적으나, 고로에서 발생된 더스트를 소결 공정이나 콜드 펠릿으로 만들어 재활용할 때 고로에 장입된 후 다시 더스트가 되어 배출된다. 이때 일부는 고로 내에 잔류하여 용선과 슬래그 등으로 배출되고 있다. 따라서 아연 함유량이 높은 더스트(20~30%) 등은 고로에서 재활용하지 못하고 탈아연 설비에서 처리하거나 외부로 반출하여 전기로 더스트와 함께 Zn를 회수하여 왔다 [4]. 특히 슬러지는 함수율이 높을 뿐만 아니라 리사이클링을 저해하는 불순물 원소도 함유되어 있으므로 곧바로 리사이클링할 수 없는 문제점이 있다 [5].
한편 Zn 함량이 0.4% 이하인 더스트의 경우 소결하여 다시 고로에서 사용하고 있다. 그러나 제선 공정에서 발생한 더스트가 water scrubbing까지 거친 고 Zn 함량의 고로 슬러지(BF sludge)가 되면 고로 내벽에 부착물(ZnO, ZnS)을 형성하게 되어 장입물의 강하 불안정, 철광석의 환원력 저하 등을 야기하므로 고로에서 리사이클링 하는 것이 불가능하다. 그리고 고로 슬러지에는 철분, 탄소 등 제철소에서 사용 가능한 유가 물질이 많이 함유되어 있다. 따라서 고로 슬러지의 리사이클링을 위하여 자력 선별, 부유 선별 등 다양한 선광 기술을 적용하여 유가 물질을 먼저 분리시키는 것이 필요하다.
그러나 고로 슬러지의 경우 다음과 같은 이유로 선광이 곤란한 경우가 많다 [6].
① 나노 크기의 미립자이기 때문에 높은 계면 에너지를 가지고 있고 표면적을 줄여 계면 에너지를 낮추려는 경향이 있어 입자들끼리 서로 인력을 발생시킨다.
② Water scrubbing 과정 후 남아있는 수분에 의해 입자가 대기에 노출되면 끈적해지고 응집하려는 경향을 보인다.
③ 응집제인 폴리아크릴 아마이드(C3H5NO)n의 사용으로 인해 각 입자들이 치밀하게 붙어있다.
따라서 고로 슬러지 중 유가 물질의 선택적 분리와 회수율을 높이기 위하여 전처리로서 슬러지의 분산이 필요하다.
고로 슬러지 중 미소 입자의 계면에 관한 물리 및 화학적 특성을 이용하면 입자들을 분산시킬 수 있다. 분산 기구에는 크게 steric stabilization(SS)과 electrostatic stabilization (ES)의 2가지로 나눌 수 있다 [7]. SS는 시스템에 추가된 고분자가 입자 표면에 흡수되어 물리적으로 입자 표면끼리의 접촉을 방해하는 것이다. 용액에 충분한 양의 고분자가 추가되면 입자간 반발력이 높아져 입자를 분산시킬 수 있으나, 입자 표면에 고착된 고분자의 제거가 곤란하여 다시 응집이 필요할 때 문제가 생길 수 있다. 또 Zn 등을 분리한 후 슬러지를 고로에서 리사이클링할 경우 제거되지 못한 고분자가 연소되면서 다이옥신 등의 유독가스가 발생된다.
한편 ES는 시스템 내 전하들의 분포에 의한 입자들의 상호작용을 이용하는 것으로, 분산제의 이온 농도를 바꾸어 분산의 안정화 및 효과적인 응집이 가능하다. 특히 ES의 경우 분산 후 정전기적 인력을 이용하여 재응집이 용이하며 가격이 저렴하다. 따라서 본 연구에서는 ES를 이용하여 고로 슬러지 중 유가 금속 회수를 위한 미소 입자의 분산 특성에 관해 조사하였다. 이러한 결과는 향후 선광을 통한 유가 물질의 분리 효율을 높이고 나아가 고로 슬러지의 리사이클링 문제를 해결하는 실마리를 제공할 수 있을 것으로 기대된다.
2. 실험 방법
본 실험에 사용한 고로 슬러지의 조성을 ICP 분석과 C/S 분석 결과를 바탕으로 환산하여 표 1에 나타내었다. 표에 나타낸 바와 같이 Fe, C, Zn 등 유가 물질들의 함량이 높으며, 제선 공정에서 플럭스로 사용된 산화물 또한 슬러지에 함유되어 있는 것을 알 수 있다.
고로 슬러지 시료의 무게를 조건에 맞게 칭량하여 증류수 100 mL와 함께 비커에 주입하였다. 분자의 운동성을 높이기 위하여 히팅 맨틀(MTOPS, MS-EAMDS9602-03)을 이용하여 70 °C까지 가열하였고 [8] 테프론 임펠러(IKA Works incorporation, RW 20)를 이용하여 350~370 rpm의 속도로 60분 동안 기계적으로 교반하였다. 그 후 프로브(probe)형 초음파 분산기(SONICS incorporation, VC-500)로 다시 30분 동안 분산시켰고, 분산이 끝난 후 각 용액의 pH를 측정한 뒤 zeta(ζ) potential과 hydrodynamic size를 측정(Malvern Instruments Ltd, zetasizer nano ZS)하였다.
표 2에 실험조건을 나타내었다. 우선 고액비(g/L)에 따른 고로 슬러지의 분산 거동을 조사하였으며, 초음파 분산 시간과 초음파 세기를 변화시켜 물리적 분산 조건 변화에 따른 분산 거동을 조사하였다. 특히 슬러지 입자의 운동성을 높여 분산효과를 상승시키기 위해 모든 실험을 70 °C에서 실시하였다. 그리고 슬러지 입자의 계면 특성 변화에 따른 분산 거동을 알아보기 위하여 NaOH와 H2SO4을 첨가하여 용액의 pH를 변화시켰으며, NaCl, Na2SiO3, (NaPO3)6 등의 분산제를 첨가하여 분산제의 농도에 따른 슬러지의 분산 거동을 zeta potential과 hydrodynamic size 측정을 통해 조사하였다.
본 연구에서 zeta potential은 ELS(Electrophoretic Light Scattering)법으로 측정하였다 [9]. 슬러지가 분산된 용액에 전기장을 가하게 되면 하전된 입자들이 반대 전극으로 이동한다. 이로 인해 빛의 산란이 주기적으로 바뀌게 되며, 이를 측정하면 전기 영동 이동도(U(m2/(V·s))가 결정되고, 이 값을 식 (1)의 Smoulouchowski coagulation식에 대입하여 zeta potential(mV)을 계산하였으며, μ는 매질의 점도(kg/(m·s)), ε는 매질의 전기 투과율(F/m)을 나타낸다.
Hydrodynamic size는 DLS(Dynamic Light Scattering)법으로 측정하였다. 입자들은 용액 내에서 끊임없이 불규칙적으로 움직이는 운동(Brownian motion)을 한다. 용액에 빛을 산란시키면 브라운 운동에 의존한 파형을 알 수 있는데 이를 자기 상관계수를 이용하여 정량화함으로써 병진확산계수 D(m2/s)를 측정할 수 있고, 식 (2)의 Stokes-Einstein식을 통하여 hydrodynamic size dh(nm)를 계산하였으며, κB는 볼쯔만 상수(1.38 × 10-23 J/K), T는 절대온도(K)를 나타낸다.
3. 실험결과 및 고찰
3.1 고로 슬러지 분석
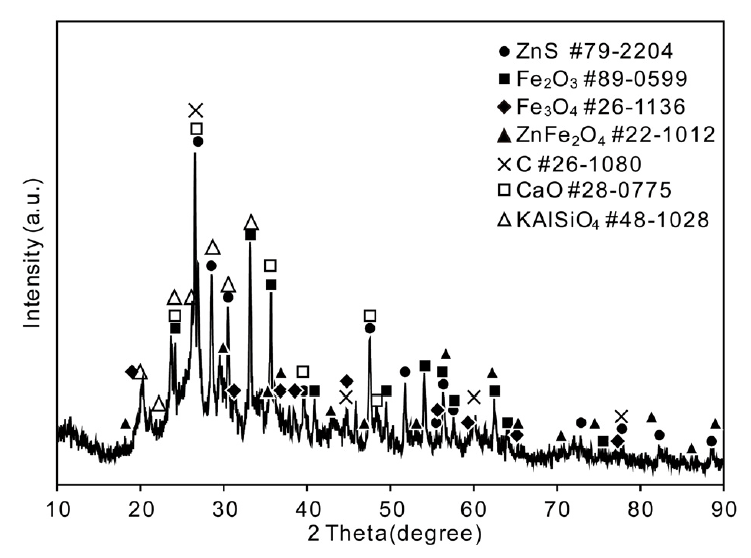
그림 2에는 본 실험에 사용한 고로 슬러지 입자의 X-선회절 분석 결과를 나타내었다. 표 1에 나타낸 ICP 분석결과와 마찬가지로 C, Zn, Fe, Al, Ca 등이 검출되었다. Zn의 경우 대부분 황화물로, Fe는 Fe2O3 및 Fe3O4의 형태의 산화물로 존재하였으나 ZnFe2O4 형태의 복합 산화물도 검출되었다. Al, K, Si은 대부분 복합 산화물 형태로 존재하였다.
그림 3에는 고로 슬러지 입자의 TEM(transmission electron microscope)과 EDS(energy dispersive X-ray spectroscopy) 분석 결과를 나타내었다. 그림에서 볼 수 있듯이 C, Fe, Zn 등의 성분들이 1 μm 이하의 미립자로 분포하였으며, C의 경우에는 단일 입자로 존재하였다. Fe와 Zn는 각각 Fe2O3, ZnS로 존재하는 것을 알 수 있으며 이는 그림 2의 XRD에서 관찰된 상과 일치하였다. 그리고 유가 물질인 Zn, Fe, C 등은 응집되어 있으므로 이들을 분리하여 회수하기 위해서는 슬러지의 분산이 필요하다.
3.2 고액비의 영향
그림 4에 zeta potential과 hydrodynamic size를 모식적으로 나타내었다. zeta potential은 현탁액 중 입자에 존재하는 전기 화학적 특성이다. 특정 전하로 하전된 입자는, 용액 중 반대 전하를 가지는 이온에는 인력을 가지고 같은 전하의 이온에는 척력을 가지게 된다. 따라서 입자의 표면에 반대 전하의 이온이 흡착되어 생성되는 고정적인 전기층(inner Helmholtz plane)이 형성된다. 또 현탁액 내에서 이온은 열역학적 운동에 의해 균일한 농도 분포를 가지기위해 반대 전하 이온이 입자 표면으로부터 어느 정도 떨어진 곳까지 층(diffuse layer)을 이루고 있다. Diffuse layer 내에는 반대 전하의 이온과 입자가 안정한 독립체를 형성하는 경계선(shear plane)이 존재한다. 입자가 브라운 운동으로 이동할 때 경계선 안의 이온은 함께 이동하지만 경계선 밖의 이온은 입자와 별개로 움직인다. 이 경계선에서의 전위를 zeta potential이라고 한다. 일반적으로 단일 입자의 경우 ±30 mV 이상에서 입자 간의 반발력이 충분하여 안정한 분산 상태라고 할 수 있다 [10].
한편 hydrodynamic size는 그림 4에 나타낸 바와 같이 입자의 직경에 zeta potential 영역까지 합한 크기이다. 단일 입자에 비하여 입자가 응집되면 hydrodynamic size가 커지므로 이를 통해 슬러지 입자의 응집과 분산 정도를 간접적으로 평가할 수 있다.
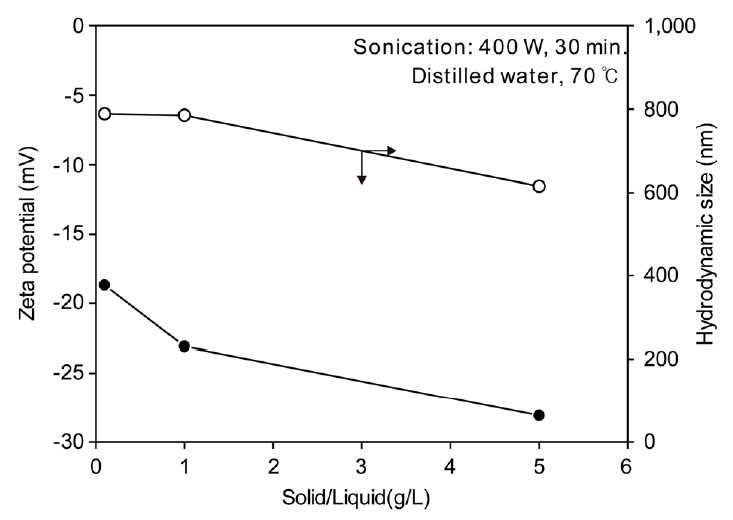
그림 5에 고로 슬러지 입자를 증류수 중에 분산시킨 경우의 고액비(g/L)에 따른 zeta potential과 hydrodynamic size의 변화를 나타내었다. 초음파 분산은 400W의 출력으로 30분 동안 수행하였다. Zeta potential은 고액비가 증가할수록 음의 절댓값이 증가하였으나, -30 mV 이내의 값을 나타내었다. 그리고 hydrodynamic size는 고액비의 증가에 따라 약간 감소하는 경향을 나타내었다. 한편 슬러지를 10 g/L 이상 넣었을 경우 zeta potential 측정용 셀에서 레이저의 투과를 위한 현탁액의 투명도가 낮아져 적절한 빛의 투과가 이루어지지 않아 zeta potential이 일정한 값을 나타내지 못하였다. 따라서 정확한 값의 측정을 위하여 이후의 모든 실험은 고액비를 5 g/L로 설정하여 진행하였다.
3.3 초음파 분산 조건의 영향
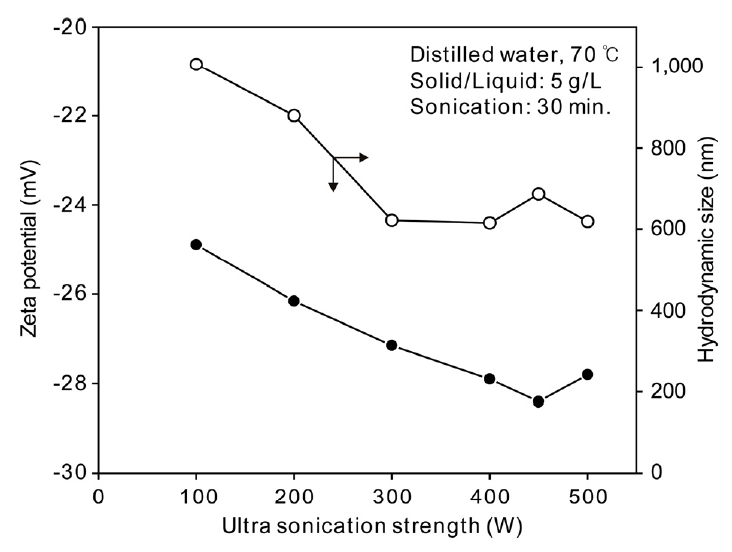
그림 6에는 초음파 강도에 따른 zeta potential과 hydrodynamic size의 변화를 나타내었다. zeta potential은 초음파 강도가 증가할수록 음의 절댓값이 증가하였으나, 초음파 강도가 400W 이상인 경우에는 큰 차이가 없었으며, -30 mV보다 높은 값을 보였다. Hydrodynamic size는 초음파 강도가 증가할수록 감소하는 경향을 보여 보다 양호한 분산 거동을 보였다. 그러나 초음파 강도가 300W 이상인 경우에는 큰 차이가 없었다.
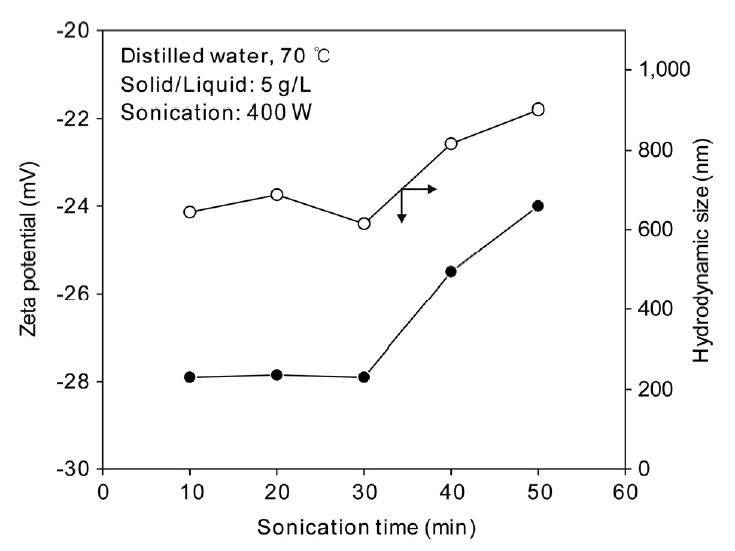
그림 7에는 초음파 분산 시간에 따른 zeta potential과 hydrodynamic size의 변화를 나타내었다. 10분에서 30분까지 초음파 분산 시간을 변화시켰을 때 zeta potential과 hydrodynamic size에 큰 차이가 없었다. 그러나 그 이상의 시간에서는 zeta potential의 음의 절댓값이 감소하였으며, hydrodynamic size는 증가하는 경향을 나타내었다.
프로브형 초음파 분산기로 분산을 할 경우, 프로브의 진동에 의해 수많은 진공 상태의 버블(bubble)이 생성된다. 이 버블들은 서로 뭉치기도 하고 커지기도 하지만 뒤이은 진동에 의해 격렬하게 파쇄되면서 용액에 격한 흐름과 소용돌이를 일으켜 강력한 충격파가 발생한다. 이러한 충격파 에너지가 반더발스(Van der Waals) 결합을 깨뜨려 양호한 분산 거동을 보인 것으로 생각된다. 그러나 분산 시간이 길어지면 초음파에 의한 버블들의 형성과 파괴가 오히려 입자들의 접촉과 상호작용을 증가시켜 응집이 일어나는 것으로 생각된다. 이러한 초음파 분산 조건별 실험 결과를 바탕으로 이후의 실험은 초음파 시간 30 분, 초음파 강도 400W를 기준으로 잡아 실시하였다.
3.3 용액의 pH 영향
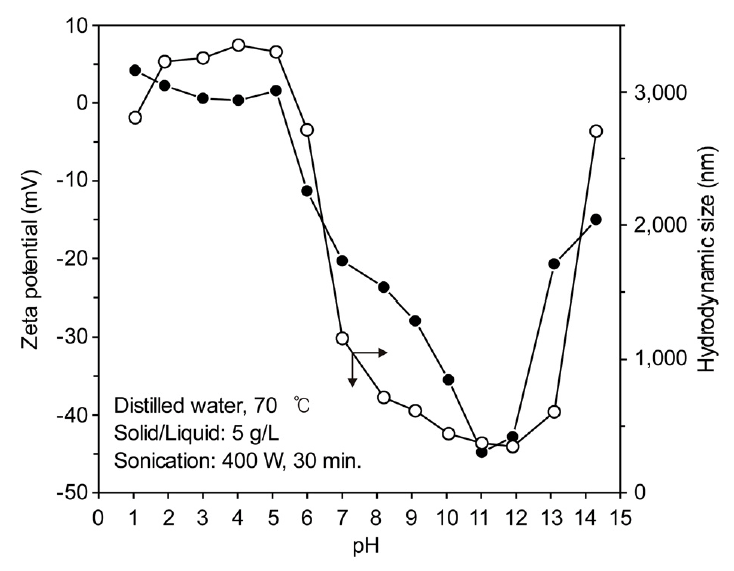
고액비가 5 g/L인 조건에서 슬러지 중 CaO가 가수 분해하여 Ca(OH)2로 되면서 용액의 pH는 9.22를 나타내었다. 따라서 zeta potential과 hydrodynamic size에 미치는 pH의 영향을 1 M의 NaOH 용액과 H2SO4 용액으로 조절하여 조사하였으며, 그 결과를 그림 8에 나타내었다. Zeta potential이 0이 되는 지점의 pH인 등전점(IEP, isoelectric point)은 pH 5~6인 것으로 판단되며, 이때는 분산 효과없이 오히려 슬러지의 응집이 촉진되었다. 등전점을 기준으로 pH가 높아질수록 zeta potential의 음의 절댓값이 증가하였고, hydrodynamic size는 감소하였다. pH=11에서 zeta potential은 -44.8 mV를 나타내었으며, hydrodynamic size도 pH=12 부근에서 가장 작은 값을 나타내어 가장 양호한 분산 효과가 나타났다. 이러한 결과는 pH가 높아질수록 그림 4에 나타낸 입자 표면인 shear plane 내의 음이온(OH-) 밀도 증가로 인해 zeta potential의 음의 절댓값은 점점 증가하고, 따라서 hydrodynamic size가 감소하는 것으로 생각된다. 그러나 pH가 작아질수록 그림 4에 나타낸 입자 표면인 shear plane 내에서 양이온(H+) 밀도가 증가하여 zeta potential이 증가하고, hydrodynamic size 역시 점점 증가한 것으로 생각된다 [11].
한편 pH가 11 이상으로 증가하면 오히려 zeta potential과, hydrodynamic size가 증가하였다. 이러한 결과는 pH 조정을 위한 NaOH 첨가량의 증가에 따른 이온 강도 증가에 의한 것으로 생각된다. 이온 강도란 이온의 종류와 무관하게 용액에 용해된 전체 이온의 농도를 나타내는 척도이다. 이온 강도에 따른 zeta potential 및 hydrodynamic size의 변화는 DLVO (Derjaguin-Landau-Verwey-Overbeek) 이론으로 설명할 수 있다 [12]. DLVO 이론에 따르면 입자들은 브라운 운동에 의해 서로 상호 작용하고 이로 인해 입자 사이에 반더발스 인력과 전기 이중층의 척력이 동시에 작용한다. 따라서 용액 내 입자의 분산은 반더발스 인력과 전기 이중층에 의해 결정된다. 식 (3)에는 반더발스 인력 에너지(VA)를 나타내었으며, h는 입자 간의 거리(m), H는 Hamaker 상수이다.
H는 원자의 종류에 따라 다르지만 대부분의 경우 10-21~10-19 J이며, 이온 강도가 증가하여도 크게 변하지 않는다. 식 (4)에는 전기 이중층에 의한 척력의 에너지(VR)를 나타내었으며, σ+σ_는 단위 면적당의 표면전하 밀도(C/m2), κB는 볼츠만 상수, ε0는 진공 유전율(8.85 × 10-2), ε은 물의 유전 상수(80.4)이며, κl은 Debye length(m)의 역수로 전기 이중층 두께의 역수이다.
식(5)에 나타낸 것처럼 Debye length는 이온 강도의 식으로 정리할 수 있다. 따라서 식(5)를 식(4)에 대입하면, VR은 이온 강도가 증가할수록 척력이 감소하여 입자들의 응집이 일어나 hydrodynamic size가 점점 증가한 것으로 생각된다.
그림 9에는 pH 변화에 따른 고로 슬러지의 분산거동을 24 시간 간격으로 관찰한 결과를 나타내었다. 그림 8에 나타난 바와 같이 pH=11에서는 72 시간이 지나도 슬러지입자가 응집되지 않고 초기와 유사하게 용액 속에 현탁되어 있는 모습이 관찰되었다. 그러나 zeta potential이 0에 가까운 상태(pH=2~6)에서는 24 시간 이내에 슬러지 입자가 응집되어 바닥으로 침강된 것을 관찰할 수 있었다.
3.4 분산제 종류의 영향
그림 10에는 분산제인 NaCl, Na2SiO3, (NaPO3)6의 첨가량에 따른 zeta potential(a)과 hydrodynamic size(b)의 변화를 비교하여 나타내었다. 전체적으로 zeta potential과 hydrodynamic size는 (NaPO3)6<Na2SiO3<NaCl순으로 나타나 (NaPO3)6의 첨가가 고로 슬러지의 분산에 가장 효과적인 것을 알 수 있다.
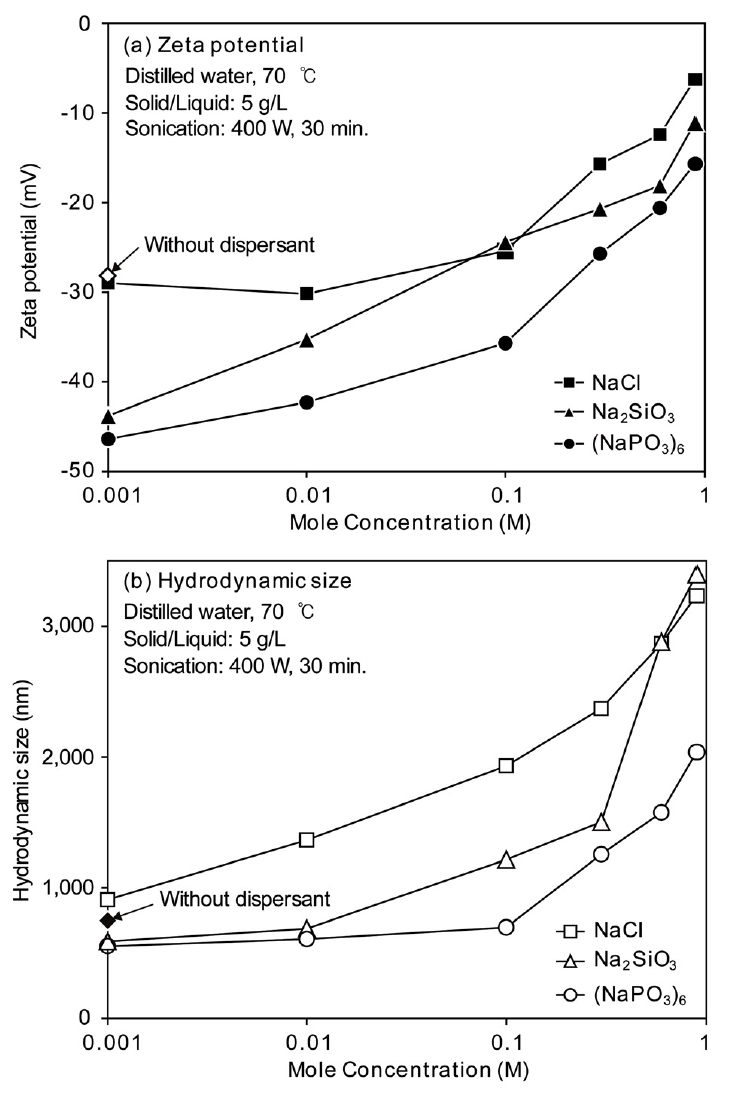
Effect of dispersant concentration on zeta potential and hydrodynamic size: (a) zeta potential, (b) hydrodynamic size.
고로 슬러지의 응집제로 사용한 폴리 아크릴 아마이드(C3H5NO)n는 슬러지 입자 주변에 ‘+’ 전하를 띤 체인을 만들어 미세 입자들을 이 체인에 흡착시킨다 [13]. 슬러지 입자는 체인에 흡착되면서 표면 전하를 잃어 전기적으로 중성을 띄게 되며, 반발력을 잃게 되므로 서로 응집된다. NaCl은 이러한 응집제의 역할을 상쇄해주는 역할로 사용되고 있다 [14]. 그러나 NaCl을 0.1 M 이하로 첨가한 경우 zeta potential은 약 -30 mV 수준을 나타내어 분산 효과가 크지 않았으며, 첨가량이 증가하면 급격하게 증가하였다. Hydrodynamic size 역시 NaCl 첨가량 증가에 따라 증가하였다.
Na2SiO3를 첨가한 경우, 첨가량에 따라 zeta potential과 hydrodynamic size가 증가하였으나, 0.001 M을 첨가한 경우 zeta potential은 -43.8 mV를, hydrodynamic size는 약 590 nm로 양호한 분산 효과를 나타내었다.
그림 11에는 그림 10에 나타낸 (NaPO3)6의 몰 농도 변화에 따른 고로 슬러지의 분산을 24 시간 간격으로 관찰한 결과를 나타내었다. (NaPO3)6를 0.001~0.01 M의 첨가하였을 때 72 시간까지 슬러지 입자가 응집되지 않고 용액 속에 현탁되어 있었으며, 0.1M을 첨가하였을 경우 48시간부터 서서히 입자가 응집되어 가라앉으며, 그 이상의 농도에서는 24 시간 이내에 입자들이 응집된 것을 알 수 있다.
이러한 결과는 그림 10의 zeta potential 및 hydrodynamic size측정 결과와 매우 양호한 일치를 나타내었다.
소량의 Na2SiO3를 첨가하면 아래 식과 같이 H2O와 반응하여 OH- 이온이 생성되어 pH가 증가하고, 이에 따른 반발력에 의해 분산 효과가 일어난 것으로 생각된다 [15].
그리고 식(7), 식(8)과 같이
한편 (NaPO3)6를 0.1 M 까지 첨가한 경우에도 zeta potential은 -36mV 이하의 값을 나타내었으며, hydrodynamic size는 550~700 nm 정도를 나타내어 매우 양호한 분산 효과가 나타났다. 용액 중 (NaPO3)6를 첨가하면 다음 식과 같은 분해 반응이 일어나며 [16], (NaPO3)6는 NaCl과 마찬가지로 응집제인 폴리 아크릴 아마이드(C3H5NO)n를 상쇄시켜주는 역할을 한다.
따라서 슬러지가 들어있는 용액에 (NaPO3)6가 첨가되면 식(10)과 같이 슬러지 중의 Ca2+가
4. 결 론
본 연구에서는 제철소의 제선 과정에서 발생하는 고로 슬러지 중 유가 물질의 회수를 위한 전처리로써, 미소 입자의 계면에 관한 물리 및 화학적 특성을 이용하여 입자의 분산 거동을 조사하였다. 고로 슬러지 입자의 분산 정도는 zeta potential 및 hydrodynamic size로 평가하였으며 고액비, 초음파 분산 조건, pH, 분산제 종류 등의 영향을 조사하였으며, 그 결과를 종합하면 다음과 같다.
1) 고액비(g/L)와 초음파 분산 강도가 증가할수록 양호한 분산 거동을 보였으나, 고액비가 10 g/L 이상인 경우 zeta potential을 측정할 수 없었으며, 초음파 분산 강도가 300~400W 이상에서는 zeta potential 및 hydrodynamic size가 유사였다. 그리고 초음파 분산 시간이 길어질수록 입자들의 응집이 촉진되었으며, 버블들의 형성과 파괴가 입자들의 접촉과 상호작용을 증가시켰기 때문인 것으로 생각된다.
2) 용액의 pH가 증가할수록 입자 표면에 ‘-’ 이온의 밀도가 증가하여 zeta potential의 절댓값이 증가하였으며, pH가 감소할수록 입자 표면에 ‘+’이온의 밀도가 증가하여 zeta potential의 절댓값이 감소하였다. pH=11에서 가장 좋은 분산 거동을 보였으며, 이때의 zeta potential은 -44.8mV를 나타내었다.
3) 분산제로 (NaPO3)6를 0.001 M 첨가한 경우 zeta potential은 -46.4 mV를 나타내어 가장 양호한 분산 거동을 보였으나, 분산제의 첨가량이 증가함에 따라 용액 내 이온 강도의 증가로 입자간 척력이 감소되어 입자들의 응집이 촉진되었다.