음이온 교환막 수전해에 사용되는 Cu0.72Co2.28O4 산소 발생 촉매의 합성 및 특성 분석
Synthesis and Characterization of the Cu0.72Co2.28O4 Catalyst for Oxygen Evolution Reaction in an Anion Exchange Membrane Water Electrolyzer
Article information
Trans Abstract
In this study, we investigated the morphological, crystal structural, electronic structural, and electrocatalytic properties of the inverse spinel structured copper cobalt oxide (Cu0.72Co2.28O4) catalysts. The materials were prepared by coprecipitation using various copper and cobalt precursors, and subsequent oxidation treatment. Electron microscopy, X-ray diffraction, X-ray photoelectron spectroscopy, and Brunauer Emmett Teller (BET) analyses were employed to characterize the Cu0.72Co2.28O4 catalysts. The Cu0.72Co2.28O4 catalyst, synthesized with acetate based precursors, exhibited higher activity for the oxygen evolution reaction than commercial precious IrO2 catalyst. This performance was attributed to its high surface area, sheet morphology and ratio of Co3+. The Cu0.72Co2.28O4 catalyst also showed excellent stability with a performance of 99% after 300 hours. The Cu0.72Co2.28O4 catalyst anode electrode was coupled with a Pt/C cathode electrode to construct an anion exchange membrane water electrolysis (AEMWE) cell. Our AEMWE cell achieved a current density of 644 mA/cm2 and an energy efficiency of 85% at a cell voltage of 1.8 V in 1M KOH.
1. 서 론
현재 에너지 소비량은 지속적으로 증가하는 추세이며, 이에 따른 주된 원료인 화석 연료의 소비량도 지속적으로 증가하고 있다. 하지만, 화석 연료의 매장량의 한계와 화석연료의 사용으로 발생하는 SOX, NOX, CO2와 같은 부산물로 인하여 지구온난화, 산성비 및 다양한 환경 문제가 발생하고 있으며, 이는 전 세계적인 문제가 되고 있다. 이를 해결하기 위해, 온실 가스 배출량을 국가별로 제한하는 파리 협정과 같은 신 기후 체제가 등장하게 되었고[1,2], 화석 연료를 대체하기 위한 태양열, 조력, 지열, 풍력, 바이오 매스와 수소 등 다양한 친 환경 에너지 개발에 대한 연구가 진행되고 있다[3]. 그 중 수소 에너지는 대체 에너지 원들 중 가장 높은 에너지 변환 효율을 가지며, SOX, NOX 와 같은 부산물이 발생하지 않는 친환경적 에너지로 많은 연구자들 및 여러 국가에서 주목하고 있는 에너지원이다[1]. 현재 약 95%의 수소가 화석연료의 개질을 통하여 생산되고, 나머지 5% 만이 수전해, 바이오매스, 광전기화학과 같은 방법을 통해 생산되고 있다[4]. 화석연료의 개질로 생산되는 수소는 공정 중 발생되는 온실 가스인 CO2로 인해 실질적인 친환경 에너지라 보기 어려우며, 순수 수소를 얻기 위해 추가적인 공정이 필요하다는 문제가 있다. 이를 해결하기 위해 고순도 수소를 생산할 수 있으며, 유휴 전력과 예비 전력과의 연결을 통해 수소를 대량 생산할 수 있는 수 전해에 대한 관심과 연구가 지속적으로 증가하고 있다[5,6].
수전해는 크게 저온형과 고온형 수전해로 구분되고, 저온형 수전해는 다시 알칼라인 수전해 (Alkaline Water Electrolysis, AWE)와, 양이온 교환막 수전해 (Proton Exchange Membrane Water Electrolysis, PEMWE), 음이온 교환막 수전해 (Anion Exchange Membrane Water Electrolysis, AEMWE) 3가지로 구분된다. 높은 농도 (20~30%)의 KOH를 전해질로 사용하는 AWE는 저가의 비귀금속 촉매를 사용할 수 있지만, 낮은 수소 발생 효율과 높은 시스템 유지 보수 비용으로 인해 대량의 수소 생산 시스템에 주로 사용된다. 산성 분위기에서 반응이 일어나는 PEMWE는 높은 에너지 효율로 고순도의 수소를 고압으로 생산할 수 있지만, 산성 분위기에서 안정한 고가의 Pt, Ir, Ru와 같은 귀금속 촉매를 반드시 사용해야 하기 때문에 수소 생산 및 시스템 단가가 높은 단점이 있다. 또한, 알칼리 분위기에서 반응이 일어나는 AEMWE는 AWE의 비 귀금속 촉매를 사용하는 장점과 PEMWE의 방식을 통한 고순도, 고압의 수소를 생산 할 수 있는 장점을 동시에 취할 수 있어 생산되는 수소의 단가를 절감할 수 있기 때문에 현재 주목받는 수소 생산 방식이라고 할 수 있다[7]. AEMWE에서의 산화 전극(anode)과 환원 전극(cathode)에서 반응은 다음과 같다.
Anode: 2 OH- → H2O + 1/2 O2+ 2 e- (E = 0.4 V)
Cathode: 2 H2O + 2 e- → H2+ 2 OH- (E = -0.83 V)
Total: H2O → 1/2 O2 + H2 (E = -1.23 V)
수소를 발생하는데 필요한 이론적인 전압은 1.23 V이지만 산소 발생 반응(Oxygen evolution reaction, OER), 수소 발생 반응(Hydrogen evolution reaction, HER), 전해질, Bubble, Membrane 등에 의해 발생하는 저항에 의해 과전압(overpotential)이 추가적으로 소요된다. 이 중 산소 발생에 의한 과전압이 가장 큰 비중을 차지하고 있어 이를 줄이기 위한 높은 활성을 갖는 산소 발생 촉매를 개발이 필요하다[8]. IrO2, RuO2와 같은 귀금속 촉매가 높은 전기화학적 성능으로 주된 OER촉매로 사용되고 있지만, 매장량의 한계로 인한 높은 가격과 대량 생산의 문제로 인해 이를 대체하기 위한 비 귀금속 전기화학 촉매에 대한 연구가 지속되고 있다[9,10]. 비 귀금속 촉매 중, Ni, Co, Fe의 전이금속 산화물들이 높은 산소발생 성능을 나타내고 있다. 이 중에서, 구리-코발트 촉매는 가격이 저렴한 전이 금속으로 이루어져 있으며, Co를 통한 역 스피넬 구조를 통한 높은 안정성과 Cu의 부분적 치환을 통한 높은 전도성을 가지고 있어 산소발생 촉매로 많은 연구가 진행되고 있다[11,12,15].
구리-코발트 산화물 OER 촉매를 합성하기 위해, 화학적 증착 (Chemical deposition), 가수분해법 (Hydrothermal method), 전기도금 (Electrodeposition), 공침법 (Coprecipitation)과 같은 다양한 합성 방법이 사용될 수 있다[13-21]. 이 중 pH의 변화에 따른 용해도 변화를 이용한 공침법은 대량의 촉매를 간단한 공정으로 합성할 수 있어 상업화에 유리하고, 다양한 전구물(Precursor)을 이용할 수 있다는 장점이 있다. 기존의 연구에서는 Chloride precursor를 사용하여 금속 수산화물(M(OH)2)을 합성하여 커패시터에 적용하였고, 높은 커패시터 성능을 나타내었다. 그 이유는 precursor 성분인 Cl- 이온이 M(OH)2 의 격자 내부에 침입함으로써 z축이 증가하는 구조적 변경 때문이라 서술하고 있다[22,23]. 또한 precursor의 변화에 의해 합성된 ZnO의 입자 형상 및 크기가 precursor의 변화로 인해 변화된다고 서술하고 있다[24]. 이전의 연구 결과들을 통해, precursor의 변화로 합성된 물질의 특성이 변화될 수 있음을 확인하였다.
본 연구에서는 음이온 교환 막 수전해 장치에 적용하기 위해 구리-코발트 산화물 OER 촉매를 Acetate, Chloride, Nitrate, Sulfate 계열의 copper와 cobalt precursor를 사용하여 공침법을 통해 합성하였고, Precursor 변화에 따른 구조적, 물리화학적, 전기화학적 특성을 XRD, SEM, TEM, LSV, Tafel slope 등의 분석을 통해 확인하였다. 이를 통해 Acetate precursors 로 합성된 Cu0.72CO2.28O4 촉매가 가장 우수한 OER 성능을 보여주는 것을 확인하였다.
2. 실험방법
Precursor의 변화에 따른 구리-코발트 산화물 촉매를 합성하기 위해 acetate (A), chloride (C), Nitrate (N)와 Sulfate (S)의 동일한 계열의 copper/cobalt precursor (SigmaAldrich)를 사용하였고, 침전제는 암모니아수 (NH4OH, 28~30 %, SAMCHUN)를 사용하였다. 구리-코발트 산화물을 공침법을 이용하여 합성하기 위하여, 증류수(Milli-Q, Merck)에 0.02 M의 Copper precursor와 0.02 M의 Cobalt precursor를 용해시켜 전구물 용액을 만든 후 Syringe pump를 이용하여 5 ml min-1의 속도로 NH4OH를 투하한다. 용액의 pH를 pH meter (Mettler Toledo)로 측정하여 9.5로 고정한 후, 4시간 교반하여 안정화 과정을 거쳤다. 안정화 과정이 끝난 용액을 원심분리하여 침전제를 분리하였고, 액체 질소를 사용하여 급냉, -95 ºC의 온도에서 24시간 동결 건조하였다. 건조를 마친 촉매는 막자 사발을 이용하여 분쇄 후, air 분위기에서 5 ºC min-1의 승온 속도로 300 ºC에서 4시간 열처리를 진행하여 구리-코발트 산화물을 합성하였다.
다양한 Precursor를 사용하여 합성한 구리-코발트 산화물의 형상과 원자 분포를 에너지 분산형 X-ray 분석(Energydispersive X-ray spectrometer, EDS)기기가 장착된 주사전자현미경(Field Emission Scanning Electron Microscopy, FE-SEM, JEOL, JSM-7001F)을 이용하여 확인하였다. 그리고 구리-코발트 산화물의 결정성 분석을 위해 X-ray 회절 분석(X-ray diffractometer, XRD)과 X-ray 광전자 분광 분석(X-ray photoelectron spectroscopy, XPS)을 수행하였다. X-ray 회절 분석(D/MAX 2500, Rigaku)은 Cu 타겟을 사용하여 40 kV, 200 mA로 10~80 °(2θ)에서 1° min-1의 스캔 속도로 측정하였고, XPS (K-alpha, Thermo VG Scientific)분석은 Al K (hv = 1486.6 eV)광원을 이용하여 측정하였다. 각각의 피크는 Carbon (285.0 eV)을 통해 fitting하였다. Precursor의 변화에 따른 구리-코발트 산화물의 전기화학적 특성을 분석하기 위해 3 전극 셀을 구성하여 Potentsiostat (VSP, Biologic)을 통해 상용되는 귀금속 촉매인 IrO2 (99.9%, Sigma-Aldrich)와 비교하였다. 3전극 셀의 상대 전극은 Pt wire를 사용하였고, 기준 전극은 1 M KOH에 포화된 Hg/HgO, 작동 전극은 Glassy carbon 전극(Rotating Disk Electrode, RDE)을 사용하였다. 촉매의 특성을 분석하기 위해, 20 mg의 합성된 구리-코발트 산화물과 IrO2(99.9%, Sigma-Aldrich)를 각각 1 ml의 Ethanol (anhydrous, 99.9%, SAMCHUN)에 넣고 5 wt% Nafion/EtOH solution (Dupont) 92.27 µl를 추가하여 10분간 Homogenizer (T 10 basic, IKA)와 1 분간의 tip sonication으로 분산시켜 균일한 촉매 ink를 제작하였고, 5 µl의 ink를 작동 전극 위에 담지 후 80 ºC의 온도에서 5분 동안 건조하여 담지 하였다. 이때 담지한 촉매의 적재 중량은 단위 면적 당 0.4578 mg cm-2 이다. 그 후, N2 퍼징된 1M KOH를 전해질로 사용하여 25 ºC의 온도에서 1600 rpm으로 회전시키며 전기화학적 분석을 실시하였다. 마지막으로 합성된 구리-코발트 산화물의 안정성과 실제 AEMWE 시스템에 적용하여 수소를 생산하는 실험을 진행하기 위해 촉매를 담지한 전극을 제작하였다. 0.2 g의 Copper cobalt oxide와 0.143 g의 PTFE (Polytetrafluoroethylene preparation, Sigma-Aldrich)를 Ni foam을 지지체로 하여 100 kg cm2의 하중으로 140 ºC에서 핫 프레스 과정을 거친 후, Ar 분위기에서 350 °C 에서 1시간 열처리하여 anode전극을 제작하였다. 제작된 전극은 1 M KOH에서 Pt mesh를 상대 전극, Hg/HgO saturated 1 M KOH를 기준 전극으로 사용한 3전극 셀을 구성하여 내구성 실험을 진행하였고, 제작한 anode전극과 Pt/C (40 wt% Pt, Alfa Aesar)를 carbon clothes위에 1 mgPt cm-2만큼 담지한 cathode electrode와, Fumasep-30 (Fuma-tech) membrane을 사용하여 AEMWE 싱글 셀을 체결하였다. 체결된 전기화학 셀은 0.1 M과 1M의 KOH를 전해질로 사용하여 수전해 셀의 전기화학적 분석을 실시하였다.
3. 결과및고찰
그림 1은 Precursor의 변화를 주요 인자로 두어 공침법을 통하여 합성한 구리-코발트 산화물의 실험 도식과 합성된 OER 촉매의 주사 전자 현미경(FE-SEM) 이미지이다. NH4OH의 첨가에 따라 Precursor 용액의 pH가 증가하고, 이온의 용해도의 변화함에 따라 용해되어 있던 구리와 코발트이온의 침전이 발생한다. pH가 증가함에 따라, 두 원소의 용해도 차이에 의해 pH 7까지 구리가 Cu(OH)2로 먼저 침전한다[24]. 그 후, 용액의 지속적인 pH 상승에 따라 pH 9까지 코발트 이온이 Co(OH)2로 침전한다[26]. 이때, 침전되는 코발트 이온은 우선적으로 생성된 Cu(OH)2 위에 핵을 생성하고 성장한다. 이 모든 과정은 다음의 화학식(1), (2)으로 나타난다.

Schematic illustration of synthesis process (coprecipitation method) and FE-SEM images of (a) A-CCO, (b) C-CCO, (c) N-CCO, and (d) S-CCO.
침전된 구리, 코발트 수산화물은 추가된 NH4OH로 인하여, pH가 증가함에 따라 식(3)과 (4)의 반응 과정을 거친다[25,27,28].
본 연구에서는 precursor의 변화를 통한 OER 촉매의 성능 변화를 알아보기 위해 모든 샘플의 최종 pH를 9.5로 고정하였다. 침전물을 300 ºC에서 4 시간 산화 열처리를 통해 형성된 Cu0.72CO2.28 O4의 FE-SEM 이미지를 그림 1(a)~(d)로 확인하였다. (a)는 acetate precursor, (b)는 chloride, (c)는 nitrate, (d)는 sulfate precursors를 사용하여 합성된 Cu0.72 CO2.28O4이다. 설명의 용이성을 위해, (a)~(d) 순으로 A-CCO, C-CCO, N-CCO, S-CCO순으로 명명하였다. 합성된 촉매는 10~20 µm의 두께의 얇은 판상 형상을 가지는 A-CCO(a)와 N-CCO(c)와 80 nm ~ 1 µm의 입자 형상을 가지는 C-CCO(b)와 S-CCO(d)가 관찰되었다. 이전의 연구들은 나노 시트 형상의 촉매가 입자 촉매 보다 넓은 표면적을 가지고 있어 OH- 의 흡착이 용이한 특성을 갖기 때문에 높은 전기화학적 촉매 특성을 보이는 것으로 보고되고 있다[29].
이와 같은 연구결과를 통해 합성된 촉매들 중 나노 시트 형상을 가지는 A-CCO와 N-CCO가 높은 OER 활성을 보일 것으로 사료된다.
그림 2는 precursor의 변화를 통해 합성된 Cu0.72CO2.28O4 촉매의 구조와 결정성을 파악하기 위한 X-ray 회절 패턴 (XRD) 결과이다. 그림 3(a)를 통해 합성된 모든 촉매 모두 Cu가 CO2+의 팔면체 위치에 치환되어 구리가 0.72, 코발트가 2.28의 화학적 양론을 구성하는 우수한 OER성능을 가지는 역 스피넬 구조의 Cu0.72CO2.28O4 피크 (ICSD card No. 98-003-8286)와 유사한 피크가 관찰되었다[30]. 모든 촉매에서 (311)면 피크가 36.78°에서 주도적으로 관찰되며, (220), (511), (440)면을 나타내는 강한 피크가 31.21°, 55.55°, 65.11°에서 관찰됨을 확인하였다. A-CCO, N-CCO, S-CCO의 경우, 불순물 피크가 관찰이 되지 않는 단일 Cu0.72CO2.28O4 피크만 관찰되지만, C-CCO의 경우 단사정 구조의 Copper oxide (ICDS card No. 98-062-7850)와 사방정 구조의 Chlorine과 Copper가 결합된 Cu2Cl2O (ICSD card No. 98-000-1055)와 같은 불순물이 형성된 것을 XRD 패턴을 통하여 확인하였다. 이러한 결과는 합성 시 끼게 된 Cl이, 세척과 열처리 과정에서 제거되지 않고 잔류하여 발생된 결과라 사료된다. 또한 합성된 촉매의 평균 입자 크기를 확인하기 위하여 식 (5)인 Debye-scherrer 식을 사용하였다[31].

(a)XRD patterns of Cu0.72Co2.28O4 catalyst with different precursors, and (b) the selected scan range and FWHM in the vicinity of Co3O4 (440).

Representative TEM images of (a) A-CCO, (b) C-CCO (c) N-CCO, and (d) S-CCO. EDS mapping images of (e) A-CCO, (f) CCCO, (g) N-CCO, and (h) S-CCO.
이때 d는 average crystallite size, K는 coefficient, λ는 X-ray 파장(Cu Ka = 1.54062 Å), β1/2는 반치전폭 그리고 θ는 Cu0.72CO2.28O4 (440)의 피크 위치를 나타낸다. 정확한 결정 크기를 계산하기 위해 다른 피크와 겹치지 않고 독립 적으로 위치하고 있는 (440)면을 이용하였다. 측정된 반치 전폭은 A-CCO, C-CCO, N-CCO, S-CCO순으로 1.108, 1.531, 1.229, 2.840으로 Debye-scherrer 식을 통해 계산된 합성된 구리-코발트 산화물의 결정 크기는 각각 8.51, 6.16, 7.67, 3.31 nm이다. 이는 FE-SEM 이미지를 통해 확인되었던 A-CCO와 N-CCO이 가지는 나노 시트 형상의 영향이라 사료된다. S-CCO의 경우 3.31 nm의 작은 평균 결정 크기를 가져 낮은 피크 세기를 나타내는 것을 확인할 수 있다. 이는 잔존하였던 Sulfur의 격자 침입에 의한 영향으로 인하여 발생한 결과라 사료된다[22,32]. 또한, Lattice parameter인 a를 계산하기 위해 식 (6)인 bragg’s equation을 사용하였다.
식 (6)에서 h, k, l는 면의 miller indices, λ는 X-ray의 파장(Cu Ka = 1.54062 Å) 그리고 θ는 피크의 위치를 나타낸다. 합성된 Cu0.72CO2.28O4에서 확인한 격자 상수의 경우, A-CCO는 8.098 Å, C-CCO는 8.100 Å, N-CCO는 8.099 Å 그리고 S-CCO는 8.314 Å으로 S-CCO를 제외한 모든 샘플에서 이전의 연구에 기록된 구리-코발트 산화물과 유사한 격자 상수(8.099 Å)를 가짐을 확인 할 수 있었다[33]. 합성된 촉매 들 중 S-CCO의 경우, 다른 촉매들과 비교하여 입자 크기는 작고 격자 상수는 큰 것으로 확인이 되었다. 이는 잔존하고 있는 S가 Cu0.72CO2.28O4의 격자 내부에 침입한 결과로 사료된다[32]. XRD 분석을 통해 도출된 결과는 precursor내에 포함된 anion으로 인해 발생한 핵 생성 및 핵성장의 변화로 인해 나타난 결과로 사료된다.
그림 3(a)~(h)은 합성된 Cu0.72CO2.28O4 촉매의 결정성과 나노 구조를 파악하기 위한 전자 투과 현미경(TEM) 이미지와 에너지 분광 분석(EDS) 결과이다. 그림 3(a)~(d)의 TEM 이미지에서 SEM 분석에서 확인한 것같이, A-CCO(a)와 N-CCO(c)는 각각 평균 6 nm와 9 nm의 나노 입자들이 판상 형상으로 응집함을 확인할 수 있고, CCCO(b)는 약 6 nm의 나노 입자들이 응집되어 큰 입자가 형성됨을 관찰하였다. 그리고 S-CCO(d)는 TEM 이미지를 통해 입자의 크기를 파악할 수 없는 입자 사이즈를 가짐을 확인하였다. 고 해상도 TEM(HR-TEM) 이미지를 통해, A-CCO, C-CCO, N-CCO순으로 XRD 분석과 동일한 Cu0.72CO2.28O4의 (311), (220), (400)면의 0.24, 0.29, 0.2 nm의 면간 거리를 가짐을 확인하였다. 특히, S-CCO(d)의 경우, 낮은 결정성으로 인하여 면간 거리가 관찰되지 않는 비 정질과 유사한 촉매 구조가 형성됨을 확인하였다. 이는 그림 2(a)의 XRD 패턴 내의 피크 세기를 통해 확인한 특성과 일치함을 확인하였다. 그림 3(e)~(h)의 EDS 분석결과, A-CCO(e)와 N-CCO(g)에서는 Cu0.72CO2.28O4를 구성하는 Cu와 Co가 고르게 분포된 결과를 확인하였다. C-CCO(f)의 경우 Cu가 밀집된 나노 입자가 관찰되었으며, 같은 위치에 Cl 원자의 분포가 관찰되었다. 이는 XRD 패턴에서 관찰되었던 Cu2Cl2O일 것이라 사료되고, 이는 세척과 산화 열처리를 통해서도 완전히 제거되지 않은 Cl의 영향이라 사료된다. 또한, S-CCO(h)의 경우 EDS분석을 통해 Sulfur가 촉매 내부에 고르게 분포함을 확인할 수 있었다. 이러한 결과는, 750 ºC에서 제거되는 Sulfur가 300 ºC의 열처리 온도에서 제거되지 못해 잔존하여 Cu0.72CO2.28O4의 내부에 침입해 격자를 왜곡하였기 때문에 낮은 결정성을 가지는 것이라 사료된다[22].
그림 4(a), (b)는 다양한 precursor를 사용하여 합성한 Cu0.72CO2.28O4에 대한 촉매 표면의 정성 및 정량적 분석을 진행한 XPS 분석결과이다. 합성된 모든 OER 촉매에서 Cu와 Co의 피크가 관찰되었다. 또한 구리와 코발트의 메인 피크와 높은 결합 에너지를 보이는 위성 피크 또한 관찰되었다. A-CCO에선 Cu 2p 스펙트럼에서 932.64 eV의 Cu2+ 피크와 934.14 eV의 Cu+ 피크를 관찰하였고, Co 2p 스펙트럼에선 779.16 eV와 794.37 eV의 Co3+ 피크 그리고 780.49 eV와 795.90 eV에서 CO2+ 피크를 관찰하였다. C-CCO에선 Cu 2p 스펙트럼에서 932.82 eV의 Cu2+ 피크와 934.42 eV의 Cu+ 피크를 관찰하였고, Co 2p 스펙트럼에선 779.54 eV와 794.56 eV의 Co3+ 피크 그리고 780.91 eV와 795.80 eV에서 CO2+ 피크를 관찰하였다. N-CCO에선 Cu 2p 스펙트럼에서 932.63 eV의 Cu2+ 피크와 934.23 eV의 Cu+ 피크를 관찰하였고, Co 2p 스펙트럼에선 779.19 eV와 794.34 eV의 Co3+ 피크 그리고 780.52 eV와 795.93 eV에서 CO2+ 피크를 관찰하였다. 마지막으로 S-CCO의 경우 Cu 2p 스펙트럼에서 932.62 eV의 Cu2+ 피크와 934.42 eV의 Cu+ 피크를 관찰하였고, Co 2p 스펙트럼에선 779.56 eV와 794.51 eV의 Co3+ 피크 그리고 781.20 eV와 795.79 eV에서 CO2+ 피크를 관찰하였다. XPS 분석 결과, sulfur와 chlorine과 같은 불순물로 인하여 Cu와 Co 모두 피크의 shift가 발생하였지만 유사한 피크 형태를 가짐을 확인하였다. S-CCO의 경우, Cu+ 피크가 매우 큰 것을 확인할 수 있다. 이는 잔존해 있던 sulfur가 copper와 sulfate 형태로 결합되어 관찰된 결과라 사료된다[34]. XPS 분석 결과, 모든 Co 2p1/2 피크와 Co 2p3/2 피크가 약 15 eV의 차이로 spin-orbital splitting한 것을 통해, 합성된 모든 촉매가 스피넬 구조임을 확인하였다[35].
그림 4(b)의 Co3+와 CO2+피크의 면적 비를 통해 확인한 Co3+의 비율은 각각 55.8 %(A-CCO), 52.6 %(C-CCO), 54.4 %(N-CCO), 55.6 %(S-CCO)고, 그 중 A-CCO 가 OER 활성 사이트인 Co3+가 상대적으로 가장 많은 것으로 확인 되었다[36,37].
그림 5(a)~(d)는 Cu0.72CO2.28O4의 precursor의 변화에 따른 N2 흡착-탈착 등온선과 기공 크기 분포결과이다. BET 표면적과 기공 크기 분포는 BJH(Barrett-Joyner-Halenda)분석을 통해 확인 하였다[38]. 분석을 통해 합성된 A-CCO, C-CCO, N-CCO, S-CCO의 BET 표면적과 기공 크기 분포를 측정한 결과, A-CCO(a)의 경우 43.13 m2 g-1의 표면적과 10 nm이내의 meso-pore를 가지는 것을 확인 할 수 있으며, 그림 5(b)의 C-CCO의 경우 28.64 m2 g-1의 BET 표면적과 20 ~ 70 nm의 기공 크기를 가지며, 그림 4(c)의 N-CCO의 경우 57.72 m2 g-1의 BET 과 10 ~ 20 nm의 기공 크기가 관찰되었다. 마지막으로 그림 4(d)인 S-CCO의 경우, 31.93 m2 g-1의 BET 표면적과 20 ~ 70 nm의 기공 분포를 가지는 것을 확인할 수 있다. FE-SEM과 TEM 이미지와의 비교를 통해, 나노 시트 형상을 가지는 A-CCO와 N-CCO의 경우 상대적으로 높은 BET 표면적과 20 nm이내의 평균 기공 크기를 가짐을 확인할 수 있다. 이러한 결과를 통해 높은 표면적을 가진 A-CCO와 N-CCO가 우수한 OER 특성을 가질 것이라 사료된다[39].
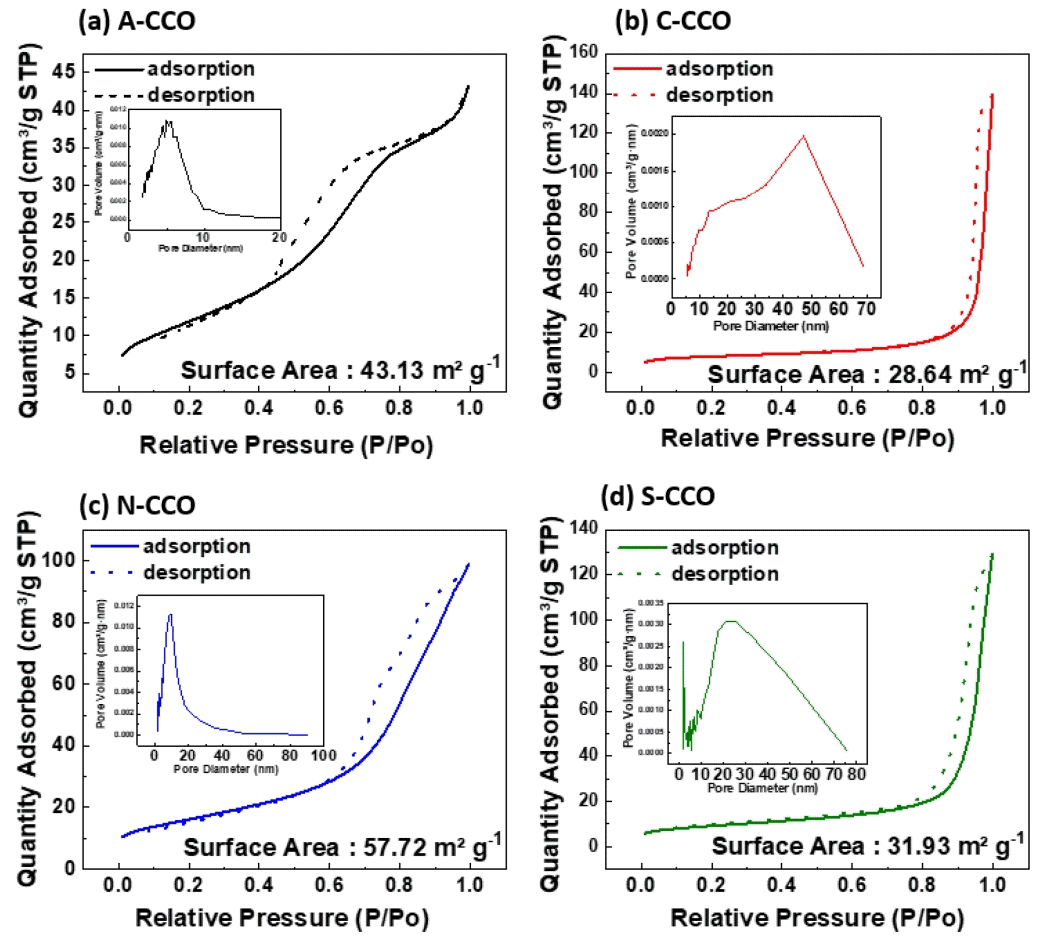
Nitrogen absorption and desorption isotherms (outside) and pore size distribution (inside) of (a) A-CCO, (b) C-CCO, (c) N-CCO, (d) S-CCO.
그림 6(a)~(d)은 합성된 Cu0.72CO2.28O4촉매의 OER 특성을 전기화학적 분석을 통하여 확인한 결과이다. 그림 6(a)는 1M KOH 전해질에서 5 mV s-1의 스캔 속도로 RDE 전극을 통하여 OER 촉매 성능 평가를 위한 선형 주사 전압-전류 분극 곡선이다. 합성된 촉매들의 OER 활성을 10 mA cm-2 지점의 과전압을 측정하였을 때, A-CCO, NCCO, S-CCO, 그리고 C-CCO에서 측정된 과전압은 각각 0.364, 0.376, 0.412와 0.367 V를 나타내었다. 실험을 통해, A-CCO가 가장 낮은 과전압 값을 가짐을 확인하였다. 이는 다른 촉매들과 비교하였을 경우 가장 낮은 포텐셜 에너지에서 OER 이 일어나는 것을 의미한다. 다음의 결과를 10 mA cm-2에서 0.419 V의 과전압을 가지는 상용되는 귀금속 촉매인 IrO2와 비교할 때, 합성된 Cu0.72CO2.28O4 전기화학 촉매가 우수한 OER 촉매 성능을 가짐을 확인하였다.
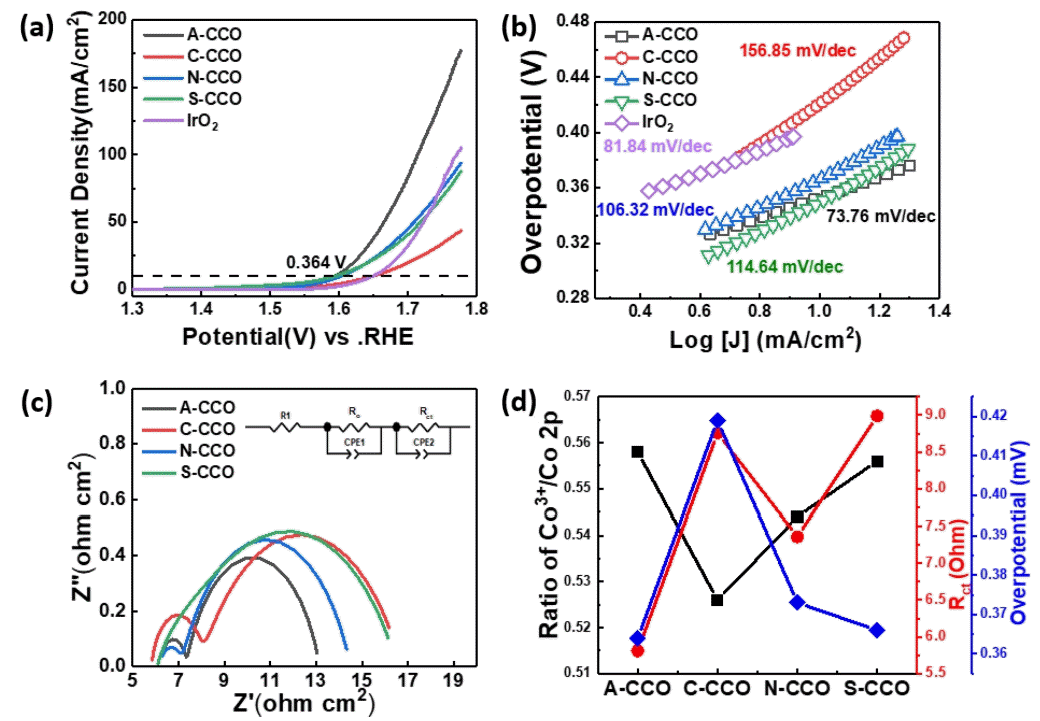
The electrocatalytic properties of prepared catalysts for OER in N2 purged 1 M KOH. (a) LSV polarization curves recorded at a scan rate of 5 mV s-1 in the potential range of 1.3 to 1.78 V vs. RHE. (b) Tafel slope from OER polarization curves. (c) EIS curves and equivalent circuit of RDE system. (d) Comparison of overpotential, charge transfer resistance from EIS analysis, and ratio of Co3+/ Co 2p from XPS deconvolution.
그림 6(b)는 서로 다른 Cu0.72CO2.28 O4의 성능에 따른 Tafel slope를 나타내고 있다. Tefel slope는 다음과 같은 식(7)을 통해 계산할 수 있다.
식 (7)에서 η는 overpotential, i는 current density, i0는 exchange current density, b는 tafel slope, b를 구성하는 parameter들인 R은 기체 상수 (8.314 J K-1mol-1), α는 symmetry factor (0.5), F는 faraday 상수 (96845 C mol-1), T는 온도, N은 반응에 필요한전자의 개수를 나타낸다. 식 (7)을 통해 Tafel slope b가 작을수록 전류 밀도를 증가시키기 위한 과전압이 작아지므로 더욱더 우수한 OER촉매 성능을 나타냄을 확인할 수 있다. 본 연구에서 합성한 ACCO, C-CCO, N-CCO, S-CCO의 Tafel slope는 각각 73.76, 156.85, 106.32, 114.64 mV dec-1로 Acetate precursor로 합성한 Cu0.72CO2.28O4가 가장 우수한 활성을 나타내는 OER 촉매임을 확인하였다. 그림 6(c)는 합성된 Cu0.72CO2.28O4의 저항 값을 알아보기 위한 임피던스 분광 분석(EIS) 결과이다. 측정된 EIS graph는 Zview software를 통해 Nyquist curve를 피팅하였다. 피팅된 그래프에서 서로 다른 두개의 반원을 관찰할 수 있다. 이는 RDE에 적층된 산화물 촉매의 불균일성으로 인하여 발생한 산화물 막 저항(Ro)과 OER 반응 시 발생하는 전하 전달 저항(Rct)으로 분류할 수 있다[40]. 이를 토대로 등가 회로를 구성하였고, 회로를 통해 A-CCO C-CCO, N-CCO와 S-CCO는 각각 5.813, 8.757, 7.359, 8.99 Ω의 전하 전달 저항 값을 가짐을 확인할 수 있다. OER 성능이 우수한 A-CCO의 경우 가장 작은 Rct값을 가짐을 확인하여 우수한 OER 촉매 성능을 가짐을 확인할 수 있었다. 그림 6(d)는 상기된 분석들을 통해 얻어진 다양한 precursor를 통해 합성된 Cu0.72CO2.28O4의 과전압, Rct 그리고 Co3+의 비율을 비교하기 위한 그래프이다. 이를 통해, 합성된 내부에 존재하는 Cu0.72CO2.28 O4의 OER 활성 사이트인 Co3+의 비율과 전하 전달 저항 값의 영향으로 인해 촉매의 OER 성능이 변화됨을 확인할 수 있다.
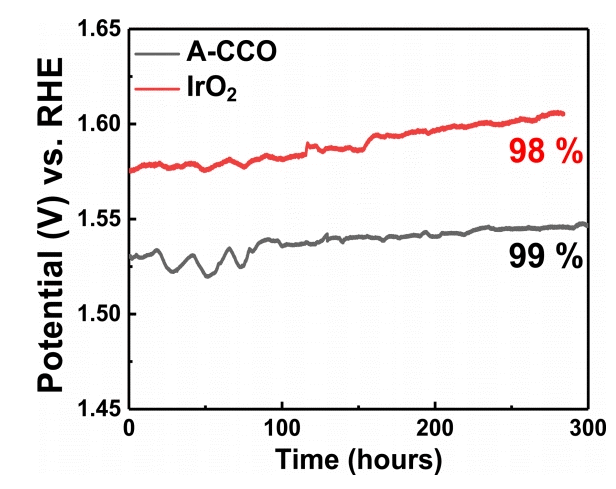
그림 7은 합성된 Cu0.72CO2.28O4 OER 촉매의 내구성 평가에 대한 결과이다. RDE를 사용할 경우, 오랜 시간의 회전에 의한 촉매 층 탈락과 산소 발생에 따른 촉매 층 분리 가능성이 있기 때문에, 정확한 내구성을 확인하기 위해 Ni foam을 지지체로 하여 내구성 테스트를 진행하였다[41]. A-CCO의 경우 10 mA cm-2의 전류를 가했을 때, 300시간동안 1.53 V에서 1.546 V로 약 99%의 성능을 유지하였고, IrO2의 경우 약 300시간동안 1.575 V에서 1.605 V로 98%의 성능을 유지하였다. 이를 통해, 합성된 Cu0.72 CO2.28O4가 귀금속인 IrO2보다 알칼라인 조건에서 우수한 내구성을 가지는 OER 촉매임을 확인할 수 있다.
그림 8(a), (b)는 하프 셀 테스트에서 우수한 OER성능을 나타낸 A-CCO를 사용하여 전극을 제작하여 AEMWE cell을 체결하여 수전해 성능을 측정한 결과이다. 단위 면적 당 10 mg cm-2를 담지한 A-CCO 전극을 통해 전기화학적 특성을 그림 8(a)로 나타내었다. 35 °C의 0.1 M KOH를 전해질로 사용하여 1.8 V에서 520 mA 그리고 동일한 온도에서 1 M KOH의 전해질에서 1.8 V에서 644 mA의 전류 밀도를 확인하였다. 또한, 500 mA cm-2의 전류 밀도에서 시간에 따라 변화하는 포텐셜 에너지 변화를 그림 8(b)을 통해 나타내었다. 다음의 그래프에서 나타나는 조건에서 bubble meter를 통해 수소 발생량을 측정하여, AEMWE의 패러데이 효율과 에너지 효율을 측정하였다[42]. A-CCO를 전극으로 사용한 AEMWE는 단위면적 당 500 mA의 전류에서 시간당 1.216 L의 수소를 생성하며, 99%의 수소 생산 패러데이 효율과, 약 85%의 에너지 효율을 나타냄을 확인하였다. 다음의 결과들을 통해, 합성된 Cu0.72CO2.28O4촉매를 통하여 우수한 효율의 AEMWE cell을 구동할 수 있음을 확인하였다.
4. 결 론
본 연구에서는 AEMWE에 사용되는 Cu0.72CO2.28O4 산소 발생 촉매를 공침법과 산화 열처리를 통하여 합성하였으며, 공침법시 사용되는 Cu와 Co precursor의 변화에 따른 촉매 특성 변화에 대해 서술하였고, 합성된 Cu0.72CO2.28O4를 AEMWE 수전해 시스템에 적용하여 확인한 결과에 대해 서술하였다. 합성된 촉매의 화학 양론 비율은 Cu: Co: O = 0.72:2.28:4로 나타났으며, 촉매의 형상은 precursor를 구성하는 anion이 핵 생성 및 핵성장에 영향을 미쳐 변화되는 형상변화를 통해 A-CCO와 N-CCO에서 나노 시트 위응집된 나노 입자가 합성된 것을 확인하였다. C-COO 와 S-COO는 precursor 성분에 의한 불순물이 생성된 것을 확인하였고, 이와 같은 영향에 의해 낮은 OER 활성을 보여주었다. XPS 분석을 통해서 A-CCO 촉매가 활성 사이트인 Co3+ 비율이 55.8%로 가장 높은 것을 확인하였다. 이러한 결과를 통해, A-CCO가 10 mA cm-2에서 0.364 V의 과전압과 5.813 Ω의 가장 낮은 전하 전달 저항을 가지며, 300 시간 동안 99%의 성능을 유지하는 높은 안정성을 가지는 우수한 OER 촉매임을 확인하였고, 실제 AEMWE cell에 적용하여 1.85 V에서 약 800 mA cm-2의 전류 밀도와 85%의 에너지 효율을 가지는 높은 성능을 보여주었다.
Acknowledgements
이 논문은 2019년도 정부 (산업자원통상부, 과학기술정보통신부)의 재원으로 한국에너지기술평가원, 한국산업기술평가관리원, 한국연구재단의 지원을 받아 수행된 연구임 (KETEP-20173010 & KEIT-10067622 & NRF2017R1D1A1B03029419)