Ti-44Al-6Nb-2Cr-0.3Si-0.1C 합금의 0.2%SO2/Ar가스에서의 고온부식
High-Temperature Corrosion of Ti-44Al-6Nb-2Cr-0.3Si-0.1C Alloy in 0.2%SO2/Ar Gas
Article information
Trans Abstract
Cast Ti–44Al–6Nb–2Cr–0.3Si–0.1C alloy having good air-oxidation resistance was corroded under 1 atm of flowing 0.2%SO2/Ar gas at 900-1100 °C for 50-300 h in order to examine its corrosion behavior in a SO2-containing environment, because SO2 is an industrially important by-product in the field of combustion and processing of fossil fuels. The corrosion rate in 0.2%SO2/Ar gas was faster than that in 0.2%O2/Ar gas, suggesting that sulfur deteriorated the corrosion resistance of the alloy. The scale consisted primarily of an outer TiO2 oxide layer with some α-Al2O3 islands, and an inner α-Al2O3-rich, TiO2-deficient oxide layer. Ti and Al, having strong oxygen affinities, preferentially oxidized to highly stable rutile-TiO2 and α-Al2O3 in the oxide scale. Small amounts of Cr and (Nb, Cr) dissolved in the outer and inner oxide layer, respectively. The outer oxide layer formed mainly by outward diffusion of Ti and Al, along with a lesser amount of Cr. The inner oxide layer formed by inward diffusion of oxygen and sulfur. The consumption of oxygen in the oxide scale facilitated the formation of Ti2S and Nb1-xS sulfides in the subscale. Oxidation and sulfidation prevailed in the oxide scale and the subscale, respectively. Sulfur migrated across the oxide scale into the subscale, where Nb, Cr, and Si accumulated to a certain extent due to their thermodynamic nobility when compared to Ti and Al. Although the alloy displayed good corrosion resistance in 0.2%SO2/Ar gas, microcracking and void formation in the oxide scale and subscale were unavoidable.
1. 서 론
γ-TiAl합금은 저밀도, 고융점, 고온에서 높은 비강도 및 우수한 크립저항을 가져 자동차와 항공우주 재료로 큰 관심을 받고 있지만, 고온에서의 내산화성은 아직도 부족한 실정이다 [1-3]. 이를 극복하기 위해 다양한 합금원소 첨가법, 표면개질법 및 코팅법이 시도되고 있다 [4]. 합금원소 첨가법에서는 TiAl합금의 주 산화물인 TiO2의 성장을 억제하거나 Al2O3의 성장을 촉진시키는 Nb, Si, Al, C, Mo, W, B, Y 등의 내산화성 증진원소를 첨가하며 [5], 표면개질법에서는 Al, Si, Cr 등을 표면에 코팅하여 고온산화시 Al2O3, SiO2, Cr2O3 등의 보호피막을 표면에 형성하도록 하는 열확산법, 내산화성 증진원소인 Nb, Al, Si 및 할로겐원소인 F, Cl, Br, I 등을 표면에 주입시키는 이온 주입법 (ion implantation) 등이 있으며 [6], 코팅법에서는 Al-X, Ti-Al, Ti-Si, MCrAlY, 세라믹산화물 등을 표면에 코팅하고 있다 [7,8].
저자 등은 우수한 인장강도와 내산화성을 지닌 Ti–44Al–6Nb–2Cr–0.3Si–0.1C 조성의 새로운 TiAl 주조합금을 제조공정이 단순하고, 효과적으로 내부식성을 증진시킬 수 있는 합금원소 첨가법을 이용하여 개발하였다 [9,10]. 본 논문에서의 조성은 atomic%이다. 개발된 합금에서 다량의 알루미늄은 α2/γ 라멜라와 약간의 β-Ti 결정립으로 구성된 미세조직를 만들었으며, 니오븀은 내산화성을, 크롬은 연성을, 실리콘과 탄소는 고온 기계적 성질을 향상시키기 위해 첨가하였다. 개발된 합금의 내산화성은 상용의 TiAl합금과 유사하게 우수하였으며, 대기중, 900-1000 °C에서 100 시간동안 산화시켰을 때는 표면에서부터 TiO2 외부층, Al2O3 중간층, TiO2-잉여 내부층이 형성되었으며, 합금원소인 Nb, Cr, Si은 산화막 하부에 편석되고, 산화막/모재계면에는 TiN과 Ti2AlN이 석출되었다 [9,10]. 개발된 합금의 다양한 가스분위기에서의 고온부식거동을 규명하기 위하여 본 연구에서는 SO2 가스분위기에서 부식시험을 실시하였다. SO2 가스는 산화 분위기에서 S를 함유한 화석연료의 연소, 처리공정에서 생성되며, 비양론성이 높아서 결함의 확산이 빠르고 융점이 낮은 비보호적 황화물을 생성할 수 있으므로 SO2에 의한 황화부식은 대기 중 고온산화보다 휠씬 유해하다 [11-13]. 황화 분위기에서의 내부식성은 석유정제, 석유화학공정, 석탄/코크스 가스화 장치, 소각기, 가스터빈, 화력발전소 및 열교환기 등의 여러 산업분야에서 중요하다. 본 연구에서는 대기중 고온부식과는 달리 TiN, Ti2AlN을 석출시키는 질소는 없고, 황화물을 만들 수 있는 황이 존재하는 0.2%SO2/Ar 가스 분위기에서 개발된 합금을 900-1100 °C 온도에서 부식시켜, 부식 반응속도, 부식생성물, 스케일 형태, 합금원소의 역할 및 부식 기구를 조사하였다.
2. 실험 방법
Ti-44Al-6Nb-2Cr-0.3Si-0.1C 합금을 주조한 후, 기공을 제거하기 위해 1250 °C에서 200 MPa로 2 시간 동안 고온등압압축(HIP)하고, 1400 °C에서 40 분 동안 아르곤 분위기에서 열처리하고, 1280 °C까지 노냉한 후, 실온까지 공냉시켰다 [9,10]. 10 × 10 × 3 mm3의 크기로 절단한 시편을 SiC연마지 #1000까지 폴리싱하고 아세톤과 메탄올로 초음파 세정한 후, 1기압의 0.2%SO2/Ar 가스 분위기에서 900-1100 °C에서 50-300시간 동안 튜브로 또는 열중량분석기(TGA)를 이용하여 부식시켰다. SO2 가스내의 황의 영향을 살펴보기 위하여 0.2%O2/Ar 가스에서의 부식시험도 실시하였다. 사용한 Ar, SO2 및 O2 가스의 순도는 각각 99.999%, 99.9% 및 99.9%으로서, 초고순도 SO2 가스는 없어서 99.9% 순도를 선정하였다. 부식된 시편은 전계방출 주사전자현미경 (FE-SEM), 전자탐침 미세분석기(EPMA), 고출력 X-선 회절분석기 (XRD: Cu-Kα radiation, 40 kV, 150 mA)로 분석하였다.
3. 결과 및 고찰
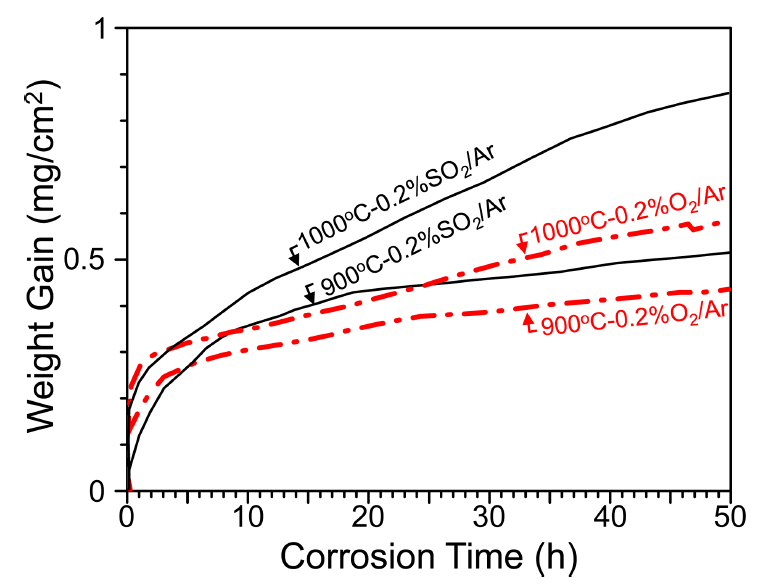
그림 1은 Ti-44Al-6Nb-2Cr-0.3Si-0.1C 합금의 부식시간에 따른 무게증가량 곡선이다. 0.2%SO2/Ar과 0.2%O2/Ar 모두에서 전체 무게증가량은 비교적 작아서 시편은 우수한 내부식성을 가짐을 알 수 있으며, 900 °C에서 1000 °C로 온도가 증가할 때 부식속도가 증가했다. 0.2%O2/Ar보다 0.2%SO2/Ar에서 합금이 더 빨리 부식되어 황은 내부식성을 저하시킴을 알 수 있다.
그림 1의 부식곡선에서 0~5시간의 초기 천이부식시간을 제외하고, ΔW2 = kp t 식을 이용하여 포물선 부식속도상수, kp,를 구하였다. 여기서, ΔW는 단위 면적당 무게증가량(mg/cm2), t는 부식시간(hr)으로서, 치밀하고 접착력이 강한 스케일내에서 이온의 확산이 부식반응을 지배할 때 시편은 포물선적으로 부식되며 이 때의 부식속도는 kp로 표현된다 [14]. 그림 2에는 Ti-44Al-6Nb-2Cr-0.3Si-0.1C 합금의 kp값 뿐만 아니라 부식속도를 비교하기 위해 대기 중에서 α-Al2O3 [15,16], TiO2 [17], Ti47Al [18], Ti50Al [19,20], Ti48Al2Cr2Nb1W [21], Ti(40-45)Al2Nb2Mo [22], Ti48Al6Nb2Cr0.04B [23] 및 Ti46.6Al1.4Mn2Mo0.3C0.6Y 합금[24]의 kp값도 나타내었다. 개발된 합금의 kp값은 0.2%O2/Ar, 0.2%SO2/Ar 및 공기 순으로 증가하는데, 이는 다음의 산소, 질소 및 황의 영향 때문이다. 첫째, 산소가 많을수록 산화는 더 쉽게 일어난다 [13]. 둘째, 대기내의 질소는 스케일/합금 계면으로 내방확산하여 TiN, Ti2AlN을 형성하여 연속적인 Al2O3 층의 형성을 방해하여 TiAl합금의 산화속도를 증가시킨다 [21,25-29]. 셋째, 황은 빠르게 성장하고 비보호적인 금속 황화물을 형성한다 [11]. 그리고, 개발된 합금의 kp값이 TiO2 생성속도보다 훨씬 작고, α-Al2O3 생성속도에 가깝다는 것은 본 합금이 강한 α-Al2O3 형성경향을 가지고 있음을 보여준다. 이와 같이 개발된 합금의 좋은 내부식성은 그림 2에 나타난 다른 TiAl 합금의 kp 값[18-24]과의 비교로부터 확실히 알 수 있다.
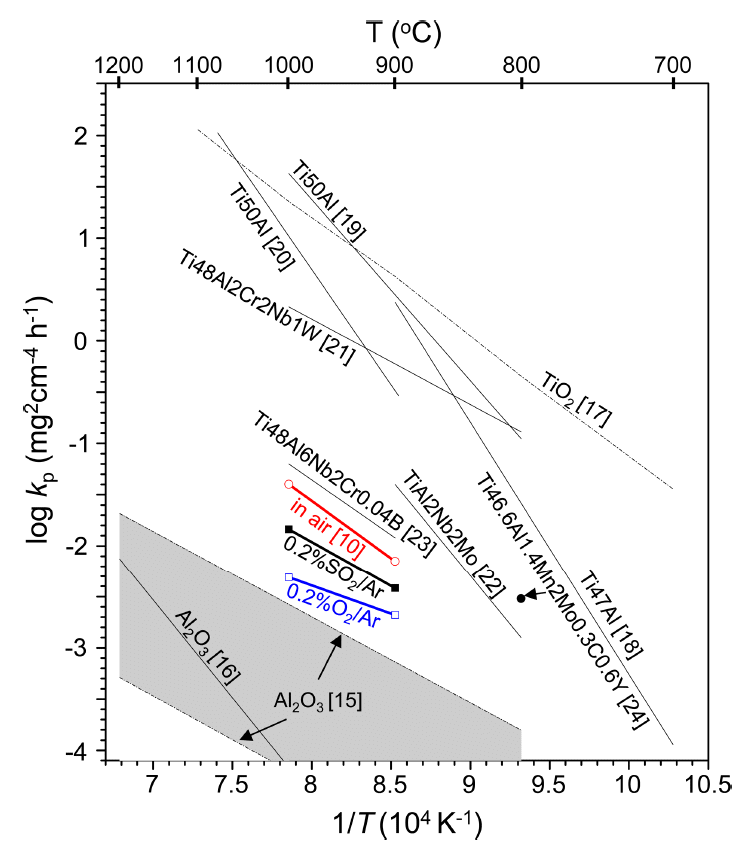
Arrehnius plot of the parabolic rate constants of Ti-44Al-6Nb-2Cr-0.3Si-0.1C at 900 and 1000 °C in air [10], 0.2%O2/Ar, and 0.2%SO2/Ar. The kp values of α-Al2O3-forming kinetics [15,16], TiO2-forming kinetics [17], Ti47Al [18], Ti50Al 19,20], Ti48Al2Cr2Nb1W [21], Ti(40-45)Al2Nb2Mo [22], Ti48Al6Nb2Cr0.04B [23], and Ti46.6Al1.4Mn2Mo0.3C0.6Y [24] in air are superimposed.
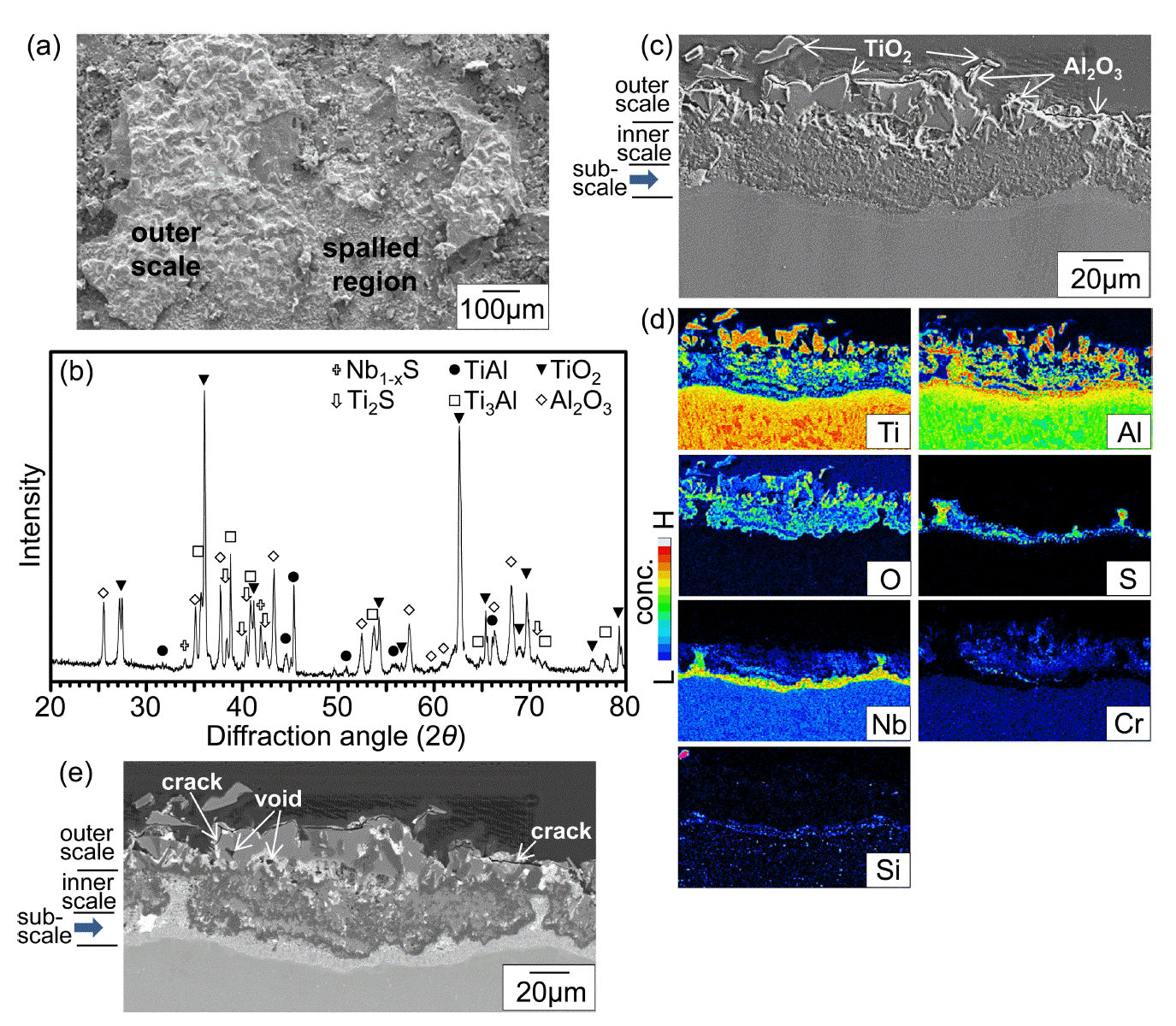
그림 3은 900 °C에서 50 시간 동안 부식시킨 Ti-44Al-6Nb-2Cr-0.3Si-0.1C의 XRD/SEM/EPMA 분석결과이다. 그림 3(a)에서 γ-TiAl와 적은 양의 α2-Ti3Al로 구성된 기지 위에 형성되는 스케일은 주산화막 rutile-TiO2와 부산화막 α-Al2O3로 구성되어 있음을 알 수 있다. 기지의 회절강도는 TiO2와 α-Al2O3의 회절강도보다 강하며, 이는 산화물 스케일이 얇음을 의미한다. 산화물과 황화물에 대한 엘링감도표에서 알 수 있듯이, 일반적으로 산화물이 황화물보다 열역학적으로 더 안정하기 때문에 Ti와 Al에서는 황화반응대신에 산화반응이 더 쉽게 일어나서 TiO2와 α-Al2O3가 우선적으로 생성되었다. 스케일 표면은 미성숙한 등축산화물 입자로 덮여 있으며 (그림 3(b)), 스케일 두께는 약 2 μm이다 (그림 3(c)). 그림 3(d)에 표시한 층 I, II, III 및 IV는 각각 외부 TiO2층, (TiO2, Al2O3)-혼합층, (O, S)가 고용된 스케일직하층 (subscale) 및 기지를 나타낸다. 층 I-II에서의 산소 소비는 층 III에서의 황의 농축을 유도하였다. 합금원소중 Nb와 Cr은 외부 TiO2층 아래에 존재하지만, Si는 스케일 전체에 불균일하게 존재한다. 이러한 상이한 원소 분포는 열역학적 인자인 합금내의 각종 원소의 산소와 황에 대한 친화력과 활동도과 동역학적 인자인 합금내의 각종 원소의 확산속도 및 스케일내에서의 각종 원소의 고용도에 의존한다 [30].
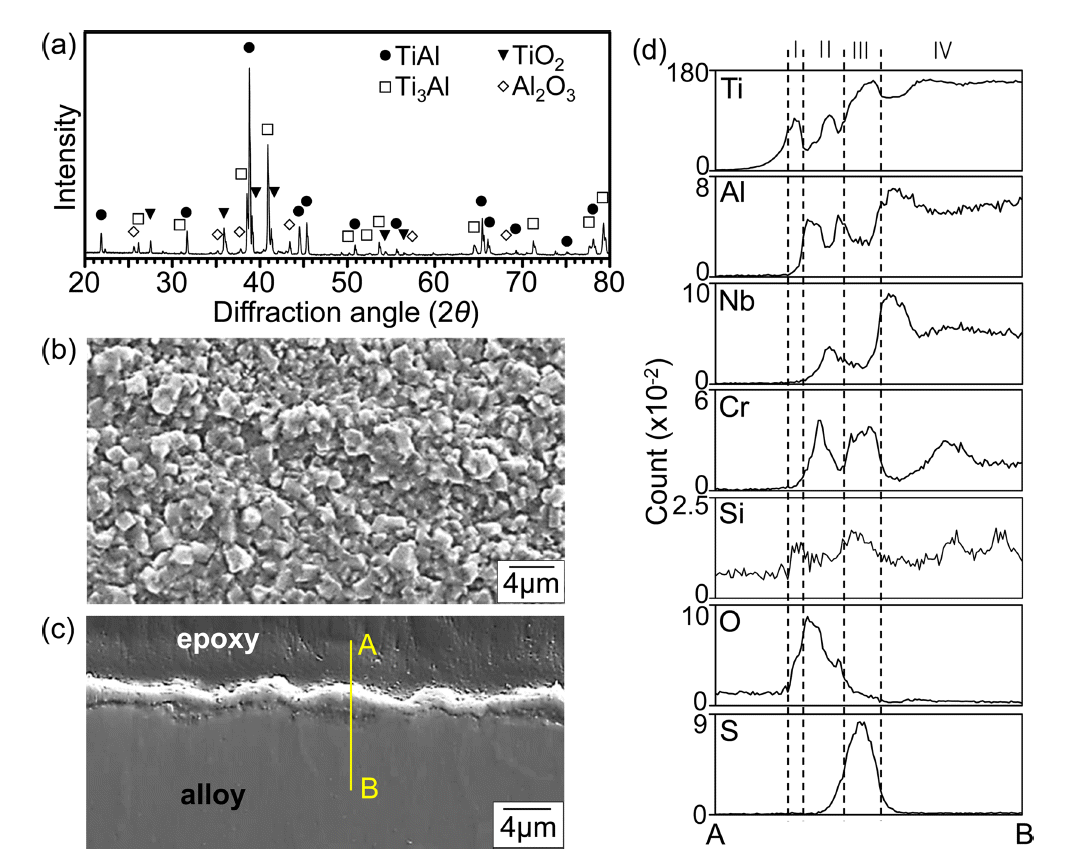
Ti-44Al-6Nb-2Cr-0.3Si-0.1C after corrosion at 900 °C for 50 h. (a) XRD pattern, (b) SEM top view, (c) EPMA cross-sectional secondary electron (SE) image, (d) EPMA line profiles along A-B shown in (c).
그림 4는 본 합금을 1000 °C에서 50 시간 동안 부식시킨 후의 XRD/SEM/EPMA 분석결과이다. 그림 3(a)와 비교하여 그림 4(a)에서는 부식온도가 증가하였기 때문에, rutile-TiO2와 α-Al2O3 회절강도가 강해지고, TiAl와 Ti3Al의 회절강도는 약해졌다. 비양론적인 TiO2는 양론적인 Al2O3보다 빠르게 성장하고, 외부 스케일을 구성하기 때문에 TiO2는 Al2O3보다 회절강도가 강하다 (그림 4(a)). 내부 스케일을 자세히 분석하기 위해 시편을 #1500 SiC연마지에서 연마하여 표면 스케일을 제거한 후, X선 분석한 결과를 그림 4(b)에 나타내었다. 여기서, (TiAl, Ti3Al)-기지, (TiO2, Al2O3)-산화물 및 (Nb1-xS, Ti2S)-황화물이 검출되는데, 황화물의 회절강도가 미약한 이유는 황화물은 산화물 형성으로 인해 산소분압이 낮아지는 스케일직하층에서 형성되었기 때문이다. 황은 격자를 통해 원자와 이온으로 화학적 확산하거나, 기공, 결정립계, 미세균열을 통해 S를 함유한 분자로 물리적 침투를 하여 산화 스케일을 가로 질러 이동한다 [31,32]. Nb, Cr 및 Si는 TiO2, Al2O3, Nb1-xS 또는 Ti2S 내에 고용되어 있어서 Nb, Cr 및 Si의 부식화합물은 그림 4(b)에서 검출되지 않았다. 스케일의 표면을 조대한 원주형태로 성장하려고 하는 rutile-TiO2결정립이 덮고 있으며 (그림 4(c)), 스케일은 약 10 μm로 두꺼웠다 (그림 4(d)). 그림 4(e)에서 약 5 μm 두께의 다량의 TiO2와 소량의 Al2O3로 구성된 외부산화층, 약 5 μm 두께의 다량의 Al2O3와 소량의 TiO2로 구성된 내부산화층, 스케일에서의 산화반응에 의해 산소가 결핍되고 황이 농축된 Nb1-xS와 Ti2S가 존재하는 약 5 μm 두께의 스케일직하층(subscale)이 보인다. 부식시 합금원소의 역할은 다음과 같다. 첫째, TiO2에 더 높은 원자가를 지닌 Nb5+이온이 고용되면 도핑(doping) 효과에 의해 TiO2의 성장이 느려져서 스케일 두께가 현저히 감소하고, 부식 중 스케일에 축적되는 성장 및 열 응력을 감소시켜 스케일 접착력이 증가된다 [33,34]. 둘째, 실리콘은 SiO2 보호피막을 형성할 수 있는 내부식성 원소이다 [7,35]. 셋째, TiO2에 더 낮은 원자가를 지닌 Cr3+이온이 고용되면 도핑효과에 의해 TiO2의 성장이 빨라져서 스케일 형성속도가 증가된다 [5]. 넷째, 탄소는 CO(g)로 산화될 수 있기 때문에 해롭다. 본 연구에서는 Cr의 함량은 2%로 낮고, 다량의 Nb와 미량의 Si를 첨가하여 Al2O3 형성을 촉진시켰기 때문에 외부 TiO2-잉여층과 내부 Al2O3-잉여층으로 구성된 이층 스케일이 형성되었다. 일반적으로는, TiAl합금의 산화시 외부로 성장하는 외부 TiO2층, 얇은 중간 α-Al2O3층, 내부로 성장하는 내부(TiO2, Al2O3)-혼합층으로 구성된 세층 산화물이 형성된다 [6,36]. 본 연구에서는 내부 스케일에서 Al2O3가 다량 형성되어 스케일직하층에서는 Al-결핍과 Ti-농축이 발생되었다. 그림 4(e)에서 Nb, Cr, Si는 Ti 나 Al에 비하여 농도, 즉, 활동도가 높지 않아서 쉽게 산화되지 않고, 스케일로부터 밀려나려는 경향이 보인다. 그림 4(f)에서 TiO2, Al2O3 및 Nb의 존재는 원자 대비에 따라 각각 회색, 흑색 및 밝은색으로 보인다. Nb, Cr, Si, Ti 및 황이 축적된 스케일직하층에서는 부분적으로 균열이 발생하여, Ti2S와 Nb1-xS의 형성은 촉진된다 (그림 4(f)).
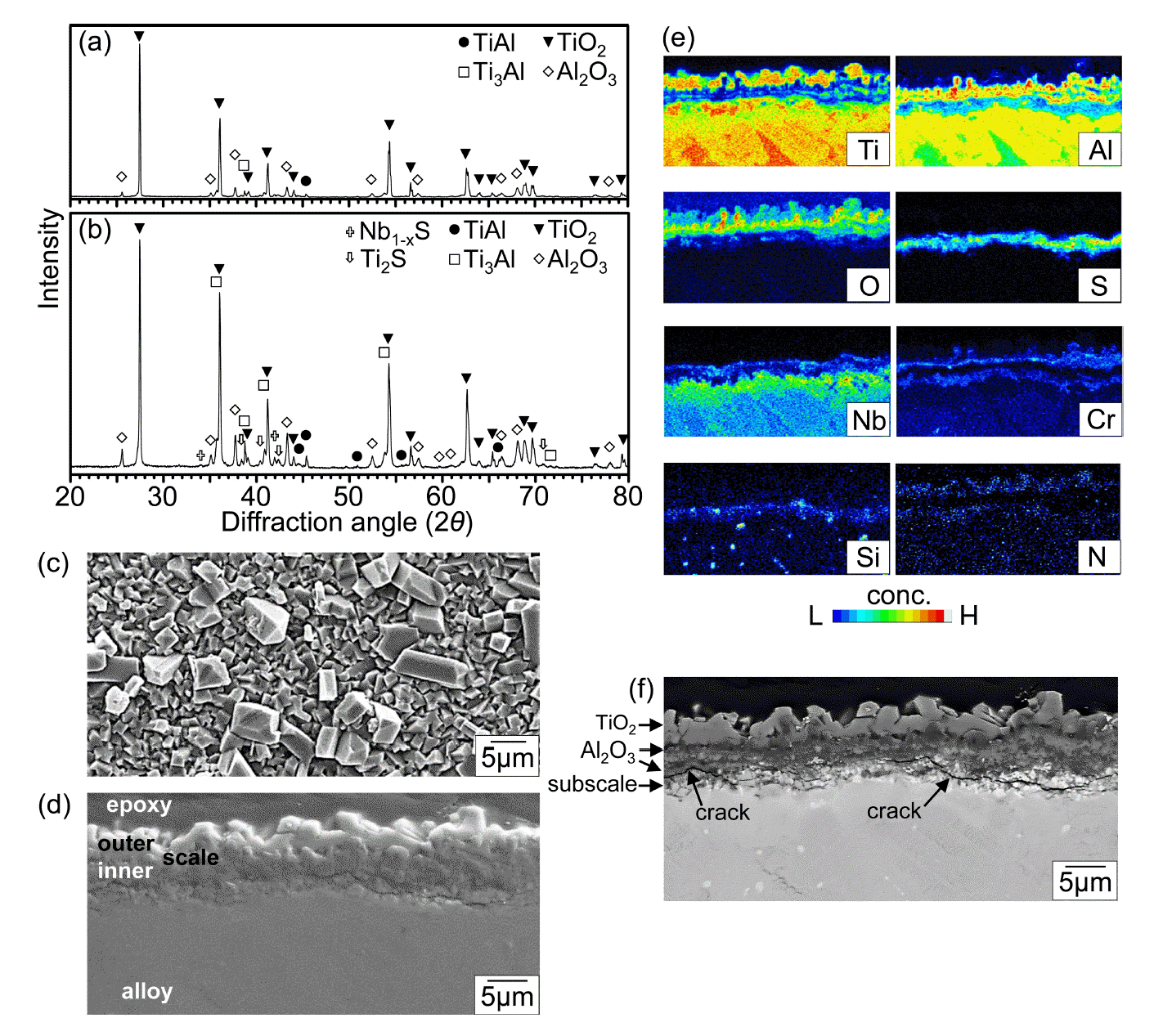
Ti-44Al-6Nb-2Cr-0.3Si-0.1C after corrosion at 1000 °C for 50 h. (a) XRD pattern before grinding, (b) XRD pattern after grinding, (c) SEM top view, (d) EPMA cross-sectional SE image, (e) EPMA maps of (d), (f) EPMA back-scattered electron (BSE) image of (d).
본 합금이 1000 °C에서 장기간 부식될 경우, 외부 rutile-TiO2 스케일 위에 돌출된 수많은 미세한 휘스커가 형성되었다 (그림 5(a)). 그림 5(b-c)의 EPMA 분석결과에 의하면 휘스커는 TiO2로 구성되며, 휘스커의 성장은 휘스커 끝을 향한 티타늄의 표면확산에 의해 지배되며, 부식이 진행되어 스케일이 두꺼워질 때 발생하는 응력은 휘스커의 성장을 촉진시킨다 [37]. 응력은 외부 스케일의 부분적 박리도 유도하였다 (그림 5(b)). 20-30 μm 두께의 스케일은 소량의 Al2O3를 함유하는 외부 TiO2층과 내부 (TiO2, Al2O3)-혼합층으로 구성된다 (그림 5(c)). 그림 5(b)의 중앙에 있는 밝은 점들은 부식 메커니즘을 연구하기 위해 부식 전에 합금 표면에 뿌린 Pd 분말(지름 1 μm)로서, Pd의 위치는 부식전 합금표면의 위치이다 (그림 5(c)의 Pd map참조). 본 Pd marker 시험에서, 부식은 Ti, Al 및 Cr의 외방확산과 산소와 황의 내방확산에 의해 지배됨을 알 수 있으며, 일부 Pd 분말은 양이온의 외방확산으로 인한 소성흐름(plastic flow)에 의해 위쪽으로 약간 밀려난 것을 그림 5(b-c)에서 알 수 있다. TiO2의 성장은 Ti4+이온의 외방확산 또는 산소 공공을 통한 O2-이온의 내방확산에 의해 지배되며 [38,39], Al2O3의 성장은 Al3+ 이온의 내방확산과 약간의 Al3+ 이온의 외방확산에 의해 지배된다 [31]. 그림 5(c)의 Cr map에서 보듯이 Cr은 일부 외방확산하여 TiO2와 Al2O3에 고용된다. 이러한 외방확산성은 Nb와 Si는 약하다 (그림 5(c)). 그리고, Nb, Si, Cr는 산소친화력이 약하여, 스케일직하층에 농축되는 경향이 있었다. 그림 4(e)와 같이, 그림 5(c)의 S map은 스케일직하층에 황이 다량 존재하여 황화물을 형성함을 보여준다. 황은 그림 5(b)에서 화살표로 표시된 미세한 기공을 통해 내부로 쉽게 침투할 수 있다. 기공은 스케일이 형성될 때 산화물의 이방성 부피팽창과 양이온의 외방확산에 의한 Kirkendall효과에 의해 생성된다.

Ti-44Al-6Nb-2Cr-0.3Si-0.1C after corrosion at 1000 °C for 300 h. (a) SEM top view, (b) EPMA cross-sectional BSE image, (c) EPMA maps of (b), (d) EPMA cross-sectional SE image.
1100 °C에서는 본 합금의 표면에는 두껍고 비보호적인 스케일이 형성되었으며, 응력집중부로 작용할 수 있는 기공의 형성과 가열/냉각 과정에서 발생한 큰 응력에 의해 스케일은 쉽게 박리되었다 (그림 6(a)). 스케일 내부를 조사하기 위해 스케일 표면을 살짝 연마한 후 X선 회절시험한 결과, 강한 강도를 가진 (TiO2, Al2O3)-산화물, 중간 강도를 가진 (Ti3Al, TiAl)-기지 및 약한 강도를 가진 (Ti2S, Nb1-xS)-황화물이 검출되었다 (그림 6(b)). 박리되지 않은 스케일의 두께는 약 80-95 μm이다 (그림 6(c)). (TiO2, Al2O3)가 혼합된 외부스케일은 국부적으로 박리되었으며, Ti4+, Al3+ 및 약간의 Cr3+ 이온의 외방확산에 의해 성장하였다 (그림 6(c-d)). Cr2O3의 TiO2내로의 고용도는 제한적이지만, Cr2O3와 Al2O3는 모두 corundum결정구조를 가져서 Cr2O3는 Al2O3내에 다량 고용가능하여 [30], 외부 스케일에서 Cr이온은 TiO2보다 Al2O3내에 더 많이 고용되어 있다. 스케일이 형성될 때 발생하는 양이온의 외방확산과 TiO2와 Al2O3가 형성될 때 발생하는 이방성 부피팽창은 내부스케일에 미세한 기공을 형성하였으며 (그림 6(c)), 스케일 중간주변에 조대한 기공을 형성하였다 (그림 6(e)). 내부스케일은 Nb와 Cr이 고용된 미세한 (TiO2, Al2O3)-혼합결정립으로 구성된다 (그림 6(d)). 황은 불완전한 산화스케일을 통해 내부로 확산되어 스케일직하층에 Ti2S와 Nb1-xS를 형성하며, 스케일직하층에는 산소친화력이 약한 원소인 Si가 미량 농축되어 있다 (그림 6(d)). 스케일 주위의 기공, 미세균열 및 원소분포는 그림 6(e)의 BSE 이미지에서도 명확히 구별 가능하다.
4. 결 론
900-1100 °C에서 50-300 시간 동안 Ti-44Al-6Nb-2Cr-0.3Si-0.1C 합금을 부식시키면 다량의 TiO2와 소량의 Al2O3로 구성된 외부스케일과 다량의 Al2O3와 소량의 TiO2로 구성된 내부스케일이 형성되며, 스케일직하층에서는 Ti와 Al에 비하여 산소친화력이 약하고, 농도, 즉, 활동도가 낮은 원소인 Nb, Cr 및 Si가 농축되려는 경향이 있었다. 스케일직하층에서 황은 Ti2S와 Nb1-xS를 형성하며, 미세균열이 존재하였다. Nb와 Si에 의해 Al2O3가 많이 형성되어서 본 합금은 1000 °C까지 우수한 내부식성을 나타내지만, 1100 °C에서는 비보호적이고, 두껍고, 접착성이 나쁘고, 기공을 다소 포함한 산화 스케일이 형성되었다. 산화물이 황화물보다 열역학적으로 더 안정하기 때문에 산화반응이 스케일 형성을 지배하였으며, 스케일에서 산소가 산화막을 만들기 위해 소비되기 때문에 스케일직하층에서는 황이 농축되어 황화반응이 지배하여 Ti2S와 Nb1-xS를 생성하였다. 부식중 Ti, Al, Cr은 외방확산하고, 산소와 황은 내방확산하였다.
Acknowledgements
본 연구는 미래창조과학부 재원으로 국가과학기술연구회의 “초청정·고효율 연료다변화형 미래에너지 생산기술 개발” 과제로 수행되었음.