폐리튬 이차전지 황산침출용액에서 Cyanex 301에 의한 구리(II)의 선택적 추출
Selective Extraction of Cu(II) from Sulfuric Acid Leaching Solutions of Spent Lithium Ion Batteries Using Cyanex 301
Article information
Trans Abstract
Spent lithium ion batteries contain cobalt, copper, lithium, manganese and nickel. Recovery of these metals with high purity from spent lithium ion batteries is of importance. A sulfuric acid solution is generally employed for the treatment of spent lithium ion batteries, but it is difficult to separate these metal ions from the leaching solution because the divalent metal ions have similar extraction behaviors. Once Cu(II) is separated from the sulfuric acid leaching solution, the traditional solvent extraction process for the separation of Co(II) and Ni(II) can be applied to the raffinate. Therefore, selective extraction of Cu(II) was investigated in this work using Cyanex 301. The effect of the concentration of sulfuric acid and Cyanex 301 was investigated. Within the sulfuric acid concentration range (pH 5-2.0 M) employed in this work, Cu(II) was completely extracted by Cyanex 301, while the extraction percentage of other metal ions decreased to negligible when the sulfuric acid concentration increased to 2.0 M. The addition of TBP to Cyanex 301 depressed the extraction of other metal ions except Cu(II) at an initial pH of 3, facilitating the selective extraction of Cu(II). The McCabe-Thiele extraction diagram indicates that most of the Cu(II) was extracted by two count-current extraction at an A/O ratio of 2. The Cu(II) loaded in Cyanex 301 was completely stripped by using 5% aqua regia.
1. 서 론
최근 휴대 전화나 컴퓨터 등의 전자 기기와 전기(EV), 하이브리드 전기(HEV) 차량의 사용량이 급격히 증가함에 따라 리튬이온 전지에 대한 수요 및 폐기물 발생량이 증가하고 있다 [1]. 리튬이온 전지는 제조 공정에 따라 5~20% 코발트, 5~10% 니켈, 5~7% 리튬, 1~5% 망간, 15% 유기화학 물질 및 플라스틱으로 구성되어 있다 [2]. 따라서 폐리튬이온 전지에 함유된 유가금속을 회수하는 것은 2차전지용 전극재료를 생산하는 데 있어 매우 중요하다 [3-5]. 폐리튬이온 전지로부터 유가 금속의 회수는 전처리, 열처리 및 화학공정으로 구성되어 있다. 이때 화학 공정은 건식과 습식으로 대별되는데 구리, 니켈, 코발트와 리튬을 고순도로 회수하기 위해서는 습식법에 의한 분리정제가 필요하다 [6-8].
습식법으로 폐리튬이온 전지 처리시 염산과 황산용액이 침출용액으로 널리 이용된다. 염산용액의 경우 염산농도 5 M 이상인 조건에서 구리(II), 망간(II), 코발트(II)는 음이온성 착물을 형성하는데 반해 니켈(II)과 리튬(I)은 양이온으로 존재하므로 니켈(II)의 선택적인 분리에 효과가 있다. 한편 2 M정도의 황산침출액에서 상기 금속이온들이 양이온으로 존재하므로 특정 이온을 선택적으로 분리하는 것이 쉽지 않다. 그러나 염산용액의 경우 5 M이상의 고농도 조건에서만 니켈의 선택적 분리가 가능하고 황산이 염산에 비해 가격이 저렴하므로 최근에는 황산용액이 폐리튬이온전지의 침출액으로 자주 이용된다. 한편 폐리튬이온 전지의 침출액에서 유가금속이온의 농도가 1 g/L 이상이므로 이온교환보다는 용매추출이 금속이온의 분리에 효율이 좋다 [9].
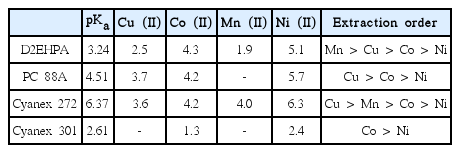
폐리튬이온 전지의 황산침출액 농도는 2 M 정도로 유가금속이온이 양이온 형태로 존재하므로 유기인산계 추출제가 주로 사용된다. 이때 구리(II), 니켈(II), 코발트(II), 망간(II)의 전하밀도가 리튬(I)의 전하밀도보다 훨씬 크므로 상기 2가 금속이온이 선택적으로 추출된다. 유기인산계 추출제인 D2EHPA, PC 88A 및 Cyanex 272에 금속이온들이 50% 추출되는 pH50값은 서로 약간씩 다르며 이를 표 1에 나타냈다 [10]. 표 1에 의하면 D2EHPA로 구리(II)와 망간(II)을, Cyanex 272로 구리(II), 망간(II)과 코발트(II)를 선택적으로 추출하는 것이 가능하다. 그러나 금속의 추출률은 금속이온과 추출제의 초기 농도뿐 아니라 수상의 초기 pH에도 의존하므로 단순히 pH50값의 차이만으로 금속의 분리성을 판단하는 것은 어렵다. 또한 유기인산계에 의한 금속 추출의 pH50값에 큰 차이가 없으므로 추출과 세정에 많은 단수가 필요하며 추출과정에서 pH의 미세 조정이 필요하다. 특히 mixer-settler를 이용한 연속공정에서 수상의 pH를 미세 조정할 필요가 있는 점은 공정의 자동화를 어렵게 만들고 있다 [11].
Variation of the pH50 values from sulfuric acid solution by organophosphrous acidic extractants for the extraction of divalent metal ions.
D2EHPA, PC 88A, Cyanex 272는 약산이므로 강산용액에서는 양이온 추출제로 추출반응에 참여하기 어렵다. 따라서 황산농도가 2 M인 폐리튬이온 전지 침출액을 pH 3 이상으로 중화시킨 다음 상기 유기인산계 추출제로 2가 금속이온을 여러 단계의 추출 및 세정으로 분리하여 리튬(I)만이 함유된 추출여액을 얻는다 [12,13]. 이러한 공정에서는 황산침출액의 중화를 위한 시약 소모등이 공정의 경제성에 악영향을 미친다. 한편 표 1에 나타낸 바와 같이 유기인산계 추출제중 Cyanex 301은 다른 유기인산에 비해 강산이므로 강산용액에서도 금속이온의 추출이 가능한 장점이 있다 [13]. 그러나 폐리튬이온 전지 황산침출액으로부터 Cyanex 301에 의한 금속분리 연구결과는 보고된 바가 적다.
니켈(II)과 코발트(II) 분리의 중요성으로 인해 여러 무기산용액에서 용매추출에 의한 분리에 대해 많은 연구 결과가 발표되었다. 따라서 폐리튬이온 전지의 황산 침출액에서 니켈(II)과 코발트(II)를 동시에 추출하는 공정은 많이 개발되었다 [14]. 그러나 구리(II)와 망간(II)이 혼합되어 있는 조건에서 니켈(II)과 코발트(II)를 선택적으로 추출하는 것이 쉽지 않다. 폐리튬이온 전지에서 망간의 함량은 다른 유가 금속에 비해 매우 낮다. 따라서 폐리튬이온 전지 황산침출액에서 구리(II)를 선택적으로 추출하면 후속 공정에서 니켈(II)과 코발트(II)를 쉽게 분리할 수 있다. 용매추출에 의한 금속분리에서 LIX 63은 구리(II)에 선택성이 있다고 알려져 있다 [15]. 그러나 폐리튬이온 전지 황산침출액에서 LIX 63으로 구리(II)를 선택적으로 분리한 연구결과는 아직 보고된 바 없다. 본 논문의 선행 연구로 2 M의 황산용액에서 LIX 63을 추출제로 사용한 결과 구리(II)는 선택적으로 추출되지 않았다.
본 논문에서는 폐리튬이온 전지의 황산침출액에서 구리(II)를 선택적으로 추출할 수 있는 조건을 조사하였다. 이러한 목적을 위해 추출제로 Cyanex 301을 사용하여 황산과 추출제의 농도를 변화시키며 구리(II), 니켈(II), 코발트(II), 망간(II) 및 리튬(I)의 추출거동을 조사하여 구리(II)의 선택적 추출조건을 얻었다. 또한 Cyanex 301과 TBP를 혼합한 용매를 추출제로 사용하는 경우 상기 금속의 추출거동에 미치는 영향을 조사하였다. Cyanex 301로 구리(II)를 추출하기 위한 McCabe-Thiele추출곡선을 작성하였고, Cyanex 301로부터 구리(II) 탈거조건을 조사하였다.
2. 실험 재료 및 방법
본 실험에서 폐리튬이온 전지 황산침출액을 모사하기 위해 증류수에 분석용 시약 CoSO4· 7H2O(Duksan Pure Chemical Co., > 98%), CuSO4·5H2O(Duksan Pure Chemical Co., > 99%), Li2SO4· H2O(Junsei Chemical Co., > 99%), MnSO4·H2O(Duksan Pure Chemical Co., > 98.5%), NiSO4·6H2O(Daejung Chemicals & Metals Co., 98.5%)를 용해시켜 제조했다. 본 논문에서는 문헌에 발표된 폐리튬 이차전지의 황산침출액 조성을 모사했으며, 모사용액의 조성을 표 2에 나타냈다 [9]. 본 실험에서는 Cyanex 301(Cytec Industries, 70%)과 TBP(Yakuri Pure Chemical Co., 98%)를 추출제로 사용했고, 희석제로 등유를 사용했다.
용매추출 실험은 분액여두에 모의 용액 10 ml와 추출제 10 ml를 넣고 상온에서 wrist action shaker를 이용하여 30분간 교반하였다. 교반 후 수상과 유기상의 혼합물을 분액깔때기에서 1시간 정치시킨 후 수상과 유기상을 분리했으며, 모든 실험은 상온(25 ± 1 oC)에서 수행하였다. 수상의 pH는 pH 미터(Orion Star model A221, USA)로 측정했다. 수상에 함유된 금속이온의 농도는 ICP-OES(Inductive Coupled Plasma Optical Emission Spectroscopy, Spectro arcos model)로 분석했고, 유기상으로 추출된 금속농도는 물질수지로 구했다.
3. 결과 및 고찰
3.1 황산농도 변화에 따른 금속의 추출
Cyanex 301는 추출제농도가 낮은 경우에는 단위체로 추출반응에 참여하지만 0.001 M이상인 조건에서는 이합체로 추출반응에 참여한다 [16]. Cyanex 301에 의한 2가 금속이온의 추출반응을 다음과 같이 나타낼 수 있다.
상기 식에서 (HA)2는 Cyanex 301의 중합체를 나타내며 하첨자 aq와 org는 각각 수상과 유기상을 나타낸다. 상기 식을 보면 수상에서 수소이온의 농도가 증가함에 따라 추출반응의 역반응이 진행하여 금속의 추출률이 감소하게 된다.
기존 연구에 의하면 폐리튬이온 전지에 함유된 유가금속의 최적 침출조건은 산화제를 첨가한 상태에서 황산농도 2 M이다 [9,13]. 일반적으로 황산농도가 0.01 M 이상인 조건에서 과산화수소와 같은 산화제를 첨가하면 구리(II)나 니켈(II) 등이 용해된다. 따라서 표 2의 조성을 지닌 용액의 황산농도를 0.01 M에서 2 M까지 변화시켜 0.5 M의 Cyanex 301로 추출실험한 결과를 그림 1에 나타냈다. 황산농도와 무관하게 구리(II)는 모두 추출된 반면 코발트(II), 니켈(II), 망간(II)과 리튬(I)의 추출률은 황산농도가 증가함에 따라 감소하였다. 금속 추출률의 황산농도 의존성으로부터 Cyanex 301에 의한 구리(II)의 추출반응과 다른 금속이온의 추출반응은 다르다고 생각할 수 있다. 즉 니켈(II), 코발트(II), 망간(II) 및 리튬(I)의 추출률은 황산농도의 증가에 따라 감소하므로 식 (1)에 의해 추출반응이 일어난다. 그러나 구리(II)는 본 논문의 황산농도범위에서 황산농도에 무관하게 모두 추출되므로 Cyanex 301과의 반응성이 매우 크다고 생각할 수 있다. HSAB(Hard soft acid base)원리에 의하면 망간(II)은 센산으로, 구리(II), 니켈(II)과 코발트(II)는 센산과 무른산의 경계로 분류된다. 따라서 다른 금속이온에 비해 구리(II)만이 Cyanex 301에 추출되는 것을 HSAB원리로는 설명하기 어렵다. 이에 대해서는 Cyanex 301에 추출된 구리(II)의 탈거 결과에서 후술할 예정이다.
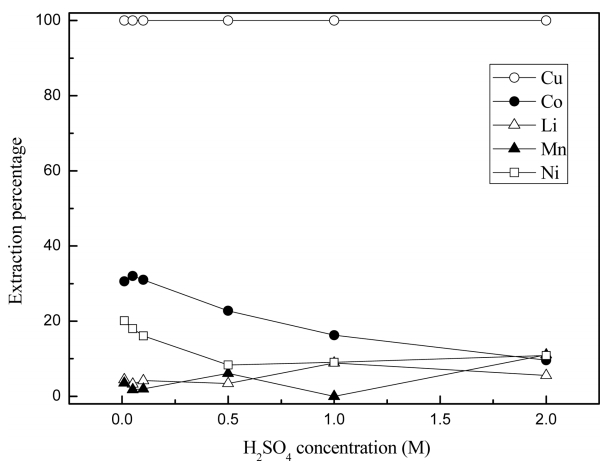
Effect of H2SO4 concentration on the extraction of metal ions from synthetic solution by 0.5 M Cyanex 301.
0.01 M의 황산용액에서 코발트(II)는 30%, 니켈(II)은 20%, 망간(II)과 리튬(I)은 약 4% 정도 추출되었다. 따라서 황산농도가 진할수록 구리(II)를 제외한 다른 금속이온의 추출률이 감소하므로 황산침출액에서 구리(II)를 선택적으로 분리하기 위해서는 황산농도를 2 M정도로 높게 유지하는 것이 유리하다. 본 논문의 황산농도 범위에서 Cyanex 301에 의한 금속이온의 추출률은 구리(II)>코발트(II)>니켈(II)>망간(II)>리튬(I) 순이었다. 황산 용액에서 Cyanex 301에 의한 코발트(II)와 니켈(II)의 pH50 값은 각각 1.63과 2.4로 본 연구결과의 추출률 순서와 잘 일치한다 [17].
3.2 Cyanex 301의 농도 변화에 따른 금속의 추출
Cyanex 301의 농도 변화에 따른 금속이온의 추출 거동을 조사하기 위해 여러 황산농도(0.01 M, 1.0 M, 2.0 M)에서 Cyanex 301의 농도를 0.01 M에서 0.25 M까지 변화시켜 실험한 결과를 그림 2, 3, 4에 나타냈다. 구리(II)의 경우 황산농도에 관계없이 Cyanex 301의 농도가 0.05 M 이상인 조건에서는 모두 추출되었다. 코발트(II)는 0.01 M의 황산농도에서는 Cyanex 301의 농도가 증가함에 따라 추출율이 증가하여 0.25 M Cyanex 301에서 20% 정도의 추출되었지만 황산 농도가 증가함에 따라 추출률이 감소하였다. 리튬(I), 니켈(II), 망간(II)의 추출률은 황산과 Cyanex 301의 농도에 큰 영향을 받지 않았고 추출률이 매우 낮았다. 본 실험결과 황산농도 0.01 M에서 2.0 M사이의 범위에서 황산농도가 높을수록 Cyanex 301로 구리(II)만을 선택적으로 추출하는 것이 용이했다.

Effect of Cyanex 301 concentration on the extraction of metal ions from 0.01 M sulfuric acid solutions.
Effect of Cyanex 301 concentration on the extraction of metal ions from 1.0 M sulfuric acid solutions.
3.3 Cyanex 301과 TBP 혼합용매에 의한 금속의 추출 거동
황산농도가 2.0 M의 용액에서 Cyanex 301로 구리(II)만을 선택적으로 추출하는 것이 가능했다. 다른 유기인산의 경우 황산용액의 pH가 3-5사이의 범위에서 분리결과가 많이 발표되었다. 따라서 Cyanex 301과 다른 유기인산에 의한 금속분리의 효율성을 비교하기 위해 황산용액의 pH를 3-5로 변화시켜 분리실험을 수행했다. 황산용액의 초기 pH가 3, 4, 5인 조건에서 Cyanex 301에 의한 금속 추출률에는 큰 변화가 없으므로 본 논문에서는 초기 pH 3에서의 결과만을 그림 5에 나타냈다. Cyanex 301의 농도가 0.01 M에서 0.2 M로 증가하더라도 금속이온의 추출률에는 큰 변화는 없었다. 황산용액의 초기 pH가 3인 조건에서 0.05 M의 Cyanex 301에 구리(II)는 모두 추출된 반면 코발트와 니켈은 각각 15%, 5% 추출되었으며 망간(II)과 리튬(I)은 추출되지 않았다. 그러나 황산농도가 2.0 M인 조건에 비해 코발트(II)와 니켈(II)의 추출률이 증가하여 구리(II)와의 분리성은 악화하였다.

Effect of Cyanex 301 concentration on the extraction of metal ions from sulfuric acid solutions with initial pH of 3.
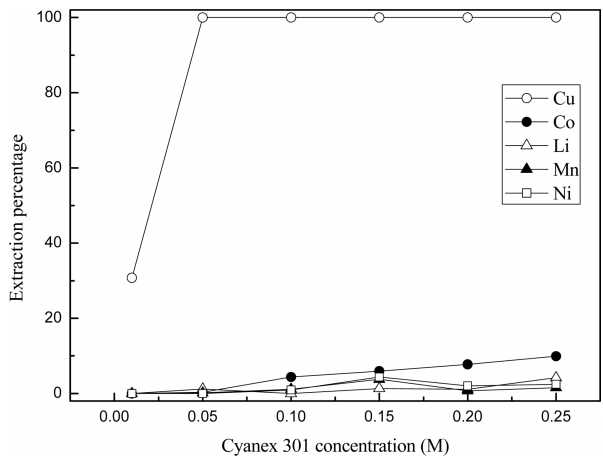
Cyanex 301에 TBP를 첨가한 효과를 조사하기 위해 황산용액의 초기 pH가 3인 조건에서 혼합용매에 의한 추출실험을 수행했다. 혼합용매에서 TBP의 농도는 0.5 M로 고정시키고 Cyanex 301의 농도를 0.01 M에서 0.2 M로 증가시킨 조건에서 실험결과를 그림 6에 나타냈다. 황산용액의 초기 pH가 3인 조건에서 Cyanex 301을 단독으로 사용시 코발트(II)는 약 20%, 니켈(II)은 5%정도 추출되었다. 그러나 Cyanex 301과 TBP 혼합용매를 사용하면 Cyanex 301을 단독으로 사용하는 추출조건에 비해 구리(II) 추출률에는 변화가 없으나 다른 금속이온의 추출률은 모두 감소하여 구리(II)의 선택적 분리에는 효과가 있었다. TBP는 용매화 추출제이며 pH가 3정도의 황산용액에서는 전기적으로 중성인 착물이 형성되기 어려우므로 본 논문의 대상 금속이온이 추출되기 어렵다. 따라서 Cyanex 301에 TBP를 혼합한 용매를 추출제로 사용시 구리(II)를 제외한 다른 금속이온의 추출률이 감소하는 것은 두 추출제간에 반응이 일어나 Cyanex 301의 유효농도가 감소한 것에 기인한다고 생각된다.
3.4 구리(II) 추출을 위한 추출등온곡선
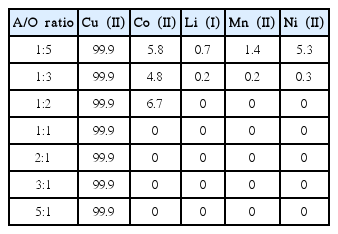
본 논문의 실험결과에 의하면 추출제로 Cyanex 301을 사용하는 경우 2.0 M의 황산농도가 구리(II)의 분리에 효과가 가장 크다. 따라서 2.0 M의 황산농도에서 구리(II)를 선택적으로 추출하는데 필요한 단수를 구하기 위해 McCabe-Thiele도를 작성하였다. 이러한 목적을 위해 수상과 유기상의 부피비를 1:5에서 5:1로 변화시켜 얻은 추출 등온곡선과 조업선을 그림 7에 나타냈다. 이때 Cyanex 301의 농도는 0.1 M로 조절하였다. 2.0 M의 황산용액에 함유된 780 mg/L의 구리(II)를 99% 이상 추출하기 위해서는 0.1M의 Cyanex 301로 유기상과 수상의 부피비(O/A)가 1:2인 추출조건에서 2단의 역류식 추출이 필요하다. 유기상과 수상의 부피비(O/A)에 따른 금속 추출률을 표 3에 나타냈다. 유기상과 수상의 부피비가 1:1 이하로 수상의 부피를 증가시키면 오직 구리(II)만이 유기상으로 추출되므로 구리(II)의 선택적 분리를 위해서는 유기상과 수상의 부피비를 1:2로 하는 것이 바람직하다. 용매추출에서 유기산에 대해 수상의 부피가 증가하면 수상에 함유된 금속을 추출하는 데 필요한 추출제의 몰수가 감소한다. 따라서 유기상에 대한 수상의 부피가 증가하면 Cyanex 301에 선택성이 있는 구리(II)만이 추출되고 다른 금속이온은 수상에 남아 구리를 선택적으로 분리하는 것이 가능하다. 이때 유기상에는 구리(II)외에 다른 금속이온이 거의 추출되지 않아 유기상에서 구리(II)의 순도가 99% 이상이었다.

McCabe Thiele diagram for the solvent extraction of Cu(II) by 0.1 M Cyanex 301 from 2.0M sulfuric acid solution.
3.5 왕수에 의한 구리 탈거
본 실험에서 Cyanex 301에 구리(II)가 선택적으로 추출되고 니켈(II), 코발트(II), 망간(II)의추출률이 낮은 것은 구리(II)가 단순한 이온교환에 의해 추출되는 것이 아니라 Cyanex 301과 결합이 강한 착물을 형성한다고 생각할 수 있다. 탈거는 추출반응의 역반응이므로 Cyanex 301에 추출된 금속이온을 탈거시 진한 무기산을 사용하면 금속의 탈거가 가능할 것으로 예상된다. 따라서 Cyanex 301에 추출된 구리(II)의 탈거에 미치는 무기산 농도의 영향을 조사하였다. 이러한 목적을 위해 본 논문에서는 무기산으로 황산, 염산, 질산을 선택하여 각 산의 농도를 1 M에서 9 M까지 변화시켜 탈거실험을 수행했다. 이때 구리(II)가 추출된 유기상을 준비하기 위해 황산농도가 2 M인 합성용액을 0.1 M의 Cyanex 301로 수상과 유기상의 부피비가 동일한 조건에서 추출했다. 추출후 Caynex 301에는 구리(II)는 모두 추출되는 반면 다른 금속은 추출되지 않았다. 이때 추출후 유기상에서 구리(II) 농도는 780 mg/L이었다. 상기 탈거제로 추출시 산의 농도에 따른 구리(II) 탈거율의 변화를 그림 8에 나타냈다. 황산과 염산을 탈거제로 사용하여 농도를 9 M까지 증가시키더라도 구리(II)는 전혀 탈거되지 않았다. 이는 구리(II)가 Cyanex 301에 단순한 이온교환반응에 의해 추출되지 않는다는 3.1 절의 고찰과 잘 일치한다. 이에 반해 질산농도를 5 M 이상으로 유지하면 구리(II)가 모두 탈거되었다. 구리(II)는 센산과 무른산의 경계에 해당하므로 HSAB원리로는 질산에 의한 구리(II) 탈거를 설명하기 어렵다. 염산은 산화력이 없고, 황산은 고온에서 산화력이 있는 반면 질산은 상온에서도 산화력이 있으며 이는 다음 반응에 기인한다.
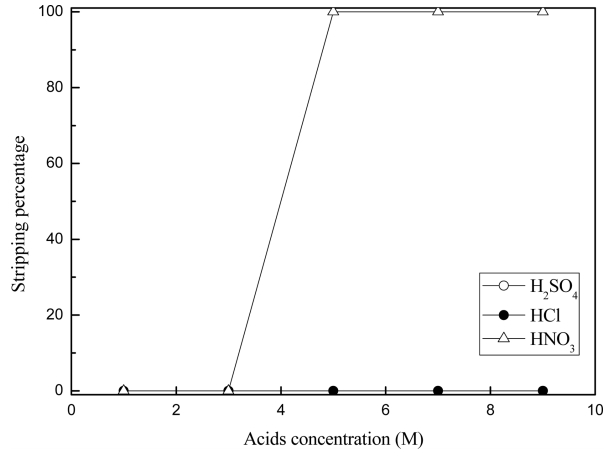
Effect of inorganic acid concentration on the stripping of Cu(II) from the loaded Cyanex 301. (Extraction conditions: [H2SO4] = 2.0 M, [Cyanex 301] = 0.1M, O/A=1:1)
식 (2)반응에 의해 생성된 산소가스에 의해 수상 또는 유기상에서 산화반응이 일어날 수 있다. 본 논문의 경우 수상에는 구리(II)만이 존재하므로 유기상에서 추출제인 Cyanex 301의 산화반응을 생각할 수 있다 [18]. 이와 같이 추출제가 산화되어 열화(Degradation)되는 경우 유기상에 추출되었던 금속이온이 탈거될 수 있다 [18]. 따라서 구리(II)가 탈거된 Cyanex 301의 추출능력 및 재생에 관한 추가 실험이 필요하다. 한편 왕수를 탈거제로 선택하여 증류수로 왕수를 희석시켜 왕수 농도를 5에서 50%까지 변화시켜 탈거실험을 수행했다. 5% 농도의 왕수를 탈거제로 사용하면 Cyanex 301에 추출된 구리(II)를 99% 이상 탈거할 수 있었다.
Cyanex 301을 사용하여 구리(II)만을 선택적으로 추출하면 여액에는 니켈(II), 코발트(II), 망간(II)과 리튬(I)이 남는다. D2EHPA와 같은 상용화 추출제를 비누화시킨 다음 초기 pH 4이상의 조건에서 추출하면 리튬(I)을 제외한 2가 금속이온을 추출하는 것이 가능하다. 이와 같은 방법으로 리튬(I)과 2가 금속이온을 분리한 다음 니켈(II), 코발트(II)와 망간(II)은 기존에 개발된 추출공정을 통해 분리하는 것이 가능할 것으로 예상된다.
4. 결 론
폐리튬 이차전지의 황산침출용액에는 구리(II), 니켈(II), 망간(II), 코발트(II) 및 리튬(I)이 함유되어 있다. 이러한 황산침출액에서 구리(II)를 선택적으로 분리하기 위한 추출조건을 조사하기 위해 추출제로 Cyanex 301을 선택하여 황산의 초기 농도를 pH 5에서 2.0 M까지 변화시켜 금속들의 추출률 변화를 조사하였다. 본 논문의 황산농도범위에서 구리(II)는 Cyanex 301에 모두 추출된 반면 다른 금속이온들의 추출률은 코발트(II)>니켈(II)>망간(II)>리튬(I) 순으로 감소하였다. 또한 황산농도가 증가함에 따라 구리를 제외한 다른 금속이온의 추출률은 감소하여 황산농도 2.0 M에서 가장 양호한 구리(II) 분리효율을 얻었다. 한편 Cyanex 301에 TBP를 혼합하는 경우 황산용액의 초기 pH가 3인 조건에서 구리(II)를 제외한 다른 금속이온의 추출률이 감소하여 구리(II)의 선택적 분리에는 효과가 있었다. 2.0 M의 황산용액을 0.1 M의 Cyanex 301로 추출하는 경우 유기상에서 구리(II)의 순도는 99%이었다. 황산용액의 농도가 2.0 M인 침출액에 함유된 구리(II)의 추출에 대한 McCabe-Thiele곡선을 작성했고 유기상과 수상의 부피비(O/A)가 1:2의 조건에서 2단의 연속식 조업을 통해 구리를 99%이상 추출할 수 있다. Cyanex 301에 추출된 구리(II)는 5 M이상의 질산용액이나 5% 농도의 왕수를 사용하여 완전히 탈거할 수 있었다.
Acknowledgements
연구는 한국연구재단에서 지원하는 개인연구지원사업 (NRF-2018R1D1A1B07044951)으로부터 연구비를 지원받아 수행되었으며 이에 감사드립니다.