Ag 코팅 Cu 플레이크의 산화 억제에 미치는 Ni interlayer 형성 도금욕의 영향
The Effect of Ni Interlayer Formation Plating Bath on the Suppression of Oxidation of Ag-Coated Cu Flakes
Article information
Trans Abstract
To suppress Ag dewetting from around 200 °C in Ag-coated Cu (Cu@Ag) flakes, Ag and Ni-coated Cu (Cu@Ni@Ag) flakes were fabricated by successive Ni and Ag electroless plating. The Ni bath type was an important consideration to induce differences in the Ag dewetting and resultant Cu oxidation. An acid Ni bath contained succinic acid as a complexing agent and sodium hypophosphite as a reductant, and an alkaline Ni bath contained sodium citrate as a complexing agent and sodium hydroxide as a pH adjuster as well as sodium hypophosphite. A hydrazine-based Ni bath contained sodium citrate, sodium hydroxide, and hydrazine hydrate as a reductant. The acid Ni bath provided amorphous coatings with a P content of approximately 10 wt%. The Cu@Ni@Ag flakes started the Ag dewetting and Cu oxidation at 350 °C, together with the formation of the Ni3P phase. Meanwhile, the alkaline Ni bath created Ni-5 wt% P amorphous Ni coatings, which transformed into a crystalline phase after heating at 350 °C. The Ag shell was dewetted at 450 °C, which caused oxidation of the flakes. Finally, the hydrazine-based Ni bath formed crystalline coatings without P, which induced rapid mixing with the core Cu. The Ag shells on the mixed Cu-Ni alloy showed repressed dewetting behavior, and thus the dewetting and oxidation temperature was the highest, such as 500 °C. Enhancing the high oxidation resistance at approximately 300 °C will enable the use of Cu@Ni@Ag flakes as a low-cost filler material in conductive pastes, especially for long-time or high-temperature curing.
1. 서 론
Ag 코팅 Cu(Cu@Ag) 입자는 순수 Ag 입자를 대체하는 저가격 소재로 경화형 도전성 페이스트의 필러(filler) 또는 최근 반도체 칩의 소결접합을 위한 페이스트 및 프리폼(preform)의 필러 소재로 연구되고 있다 [1-12]. 즉, 이러한 입자는 Cu의 저가격 특성과 우수한 전기 및 열전도도, Ag의 내산화 특성과 우수한 전기 및 열전도도의 장점만을 취하고자 개발된 것으로 순수 Cu의 산화 거동을 억제시켜 줄 것으로 기대된다. 그러나 Cu@Ag 입자의 내산화 특성은 200°C 부근에서 파괴되는 것으로 보고되어 예상보다 좋지 않은 것으로 분석되고 있는데 [4], Ag와 Cu간 약 11%에 이르는 격자 불일치(lattice mismatch) [13,14], 양(+)의 혼합 엔탈피(mixing enthalpy) 값 [15-17], 적은 전기음성도 차이 [18] 등으로 인한 계면 불안정으로 Ag 코팅층이 dewetting되기 때문이다 [4,6,7,9,11,14,19-21]. Ag dewetting 현상은 Ag 코팅층 두께의 부분적 변화를 일으키므로 얇아진 Ag 층을 투과하여 외부 확산되는 Cu는 대기 중에서 쉽게 산화되어 궁극적으로 입자의 산화를 야기시키게 된다 [22]. 상기 필러 소재로 사용 시 이러한 Cu의 산화 현상은 전기 및 열전도도의 큰 감소나, 소결접합성의 감소를 유발시키게 되므로 내산화층 코팅 Cu 입자를 대기 중에서의 경화공정에 장시간 노출시키거나 고온 대기에서 소결접합을 구현하기 위해서는 Ag dewetting을 억제시키는 대체 저가격 필러 소재의 개발이 필요하다.
Ag dewetting의 근본 원인은 Ag 층과 코어(core) Cu간의 계면 불안정성이므로 일차적인 해결 방안으로 Ag와 Cu 사이에 제 3 원소를 삽입시키는 방안을 고려할 수 있다. 이 경우 우선적으로 선택할 수 있는 제 3 원소는 Ni인데, Ni은 우수한 전기 및 열전도도 특성을 제공하는 한편 Cu와 함께 under bump metallurgy(UBM) 소재로도 적용되고 있으므로 전자 패키징 분야에서 쉽게 수용 가능한 도전 소재이다 [23]. 따라서 본 연구에서는 Ni과 Ag를 연속 무전해 도금하여 Ag와 Cu 사이에 Ni 층을 삽입한 Cu@Ni@Ag 입자를 제조함으로써 Ag dewetting 및 내산화 특성의 변화를 분석하고자 하였다. 아울러 Ni 무전해 도금은 다양한 도금욕으로 구현 가능하므로 본 연구에서는 산성, 알칼리성, 그리고 hydrazine 기반의 3종의 도금욕을 사용하여 Ni 도금을 실시한 후 가장 우수한 Ag dewetting 억제 및 내산화 특성을 나타내는 Cu@Ni@Ag 입자 제조법을 판정하고자 한다.
2. 실험방법
이후 서술되는 각 도금 공정에서의 세부 공정조건들은 점진적 조건 변화에 의한 결과 분석으로 최적 조건 범위를 정립하는 과정을 통해 결정되었다.
2.1 산성 Ni 도금욕을사용한 Cu 입자상 Ni 도금
Cu 플레이크(flake)(Duksan Hi-Metal, D50: 4.9 μm) 3 g을 120 mL의 증류수에 투입한 후 착화제인 succinic acid(C4H6O4, ≥99%, Sigma-Aldrich) 0.135 M, Ni 전구체인 nickel(II) sulfate hexahydrate(NiSO4·6H2O, 99%, Sigma-Aldrich) 0.05 M과 환원제인 sodium hypophosphite (NaH2PO2·H2O, ≥97%, Junsei) 1.5 M을 250 rpm에서 10분간의 교반으로 모두 용해시켜 Ni 도금욕을 준비하였다. 이후 히팅 맨틀(heating mantle)을 이용하여 75°C에서 30분간 가열하며 Ni 도금을 진행하였으며, 도금 중 250 rpm 교반 조건은 계속 유지하였다. 반응 완료 후 상기 교반 하에서 1시간동안 냉각시킨 다음, 제조된 Ni 코팅 Cu 플레이크를 증류수로 4회 세척한 후 건조하여 분말을 준비하였다. 코팅된 Ni 양은 10 wt%였다.
2.2 알칼리성 Ni 도금욕을사용한 Cu 입자상 Ni 도금
Cu 플레이크 3g을 sodium citrate(Na3C6H5O7·2H2O, ≥99%, Duksan) 6 g이 용해된 증류수 20 mL에 장입한 후 300 rpm에서 10분간 교반시키며 표면에 존재하는 산화층을 제거하고 증류수로 4회 세척하였다. 이후 전처리된 Cu 플레이크는 20 mL의 증류수에 분산시켜 두었다. 한편 환원제인 sodium hypophosphite 1.5 M, 착화제인 sodium citrate 0.1 M과 nickel(II) sulfate hexahydrate 6 g을 녹여 Ni 도금액을 제조하였다. 최종적으로 Cu가 분산된 증류수를 도금액에 첨가한 후 sodium hydroxide(NaOH, 99%, Sooshin Chemical)를 pH 조절제로 사용하여 pH를 11로 맞춘 다음, 75°C에서 250 rpm 교반 하 30분 동안 가열하여 Ni 도금을 실시하였다. 이후 냉각 및 세척, 건조법은 앞서와 동일하였다. 코팅된 Ni 양은 10 wt%였다.
2.3 Hydrazine성 Ni 도금욕을 사용한 Cu 입자상 Ni 도금
앞서와 마찬가지로 Cu 플레이크를 전처리 및 세척한 후 20 mL의 증류수에 분산시켜 두었다. 또한 환원제인 hydrazine hydrate(N2H4, 50-60%, Sigma-Aldrich) 774 μL, 착화제인 sodium citrate 1.409 g과 nickel(II) sulfate hexahydrate 0.9 g을 녹여 Ni 도금액을 제조하였다. 이후 Cu가 분산된 증류수를 도금액에 첨가한 후 sodium hydroxide를 사용하여 pH를 12.5로 맞추고, 75°C에서 250 rpm 교반 하 60분 동안 가열하여 Ni 도금을 실시하였다. 이후 냉각 및 세척, 건조법은 앞서와 동일하였다. 코팅된 Ni 양은 10 wt%였다.
2.4 Cu@Ni 입자상 Ag 도금
앞서 제시된 각각의 방법으로 Ni 코팅 Cu 플레이크를 제조한 직후 증류수로 4회 세척한 다음 L-ascorbic acid(C6H8O6, ≥98%, Sigma) 1 mM을 용해시킨 증류수 100 mL에 상기 플레이크를 장입하고 250 rpm에서 1분간 교반하여 플레이크를 분산시켰다. 그리고 100 mL의 증류수에 0.45 M의 ethylenediamintetraacetic acid(EDTA, ≥99.5% Junsei), 10-20 g의 sodium hydroxide와 0.833 g의 silver nitrate(AgNO3, ≥99.8%, Daejung Chemicals & Metals)를 용해시켜 Ag 도금액을 제조하였다. 제조된 도금액을 10 mL/min의 속도로 상기 Ni 코팅 Cu 플레이크 분산 용액에 10분간 투입한 후 추가로 10분을 유지시켰다. 도금액 투입 및 유지 동안 혼합 용액은 250 rpm의 속도로 지속적으로 교반되었다. 반응 완료 후 제조된 Cu@Ni@Ag 플레이크를 증류수로 4회 세척한 후 진공 건조하여 분말로 수득하였다. 코팅된 Ag 양은 15 wt%였다.
2.5 Cu@Ni@Ag 입자의 열처리
제조한 Cu@Ni@Ag 플레이크의 내산화 특성을 파악하기 위해 전기로 내에서 특정 온도까지 열처리를 실시한 다음 X선 회절(X-ray diffraction, XRD, X’pert Pro-MPD, Panalytical) 분석을 수행하여 열처리 온도에 따른 상 변화를 분석하였다. 가열속도는 25°C°C/min였으며, 열처리 온도는 350∼600°C 사이에서 50°C 간격으로 설정되었다.
2.6 기타 분석
제조된 Cu@Ni@Ag 플레이크의 표면 및 단면 형상 분석은 주사전자현미경(scanning electron microscopy, SEM, JSM-7500F, JEOL)을 사용하여 실시하였다. 또한 성분 분석을 위해 에너지 분산형 X-선 분광법(energy-dispersive X-ray spectroscopy, EDS) 분석도 실시하였다. 아울러 제조 Cu@Ni@Ag 분말에서의 산화 온도를 측정하기 위해 열중량-시차주사열량계(thermo gravimetry-differential scanning calorimetry, TG-DSC, Q600, TA Instruments) 분석을 대기 중에서 실시하였다. 승온 속도는 10°C/min였으며, 산화 온도는 TG 곡선의 기저부 접선과 상승 영역 접선의 교점 온도로 정의하였다.
3. 결과 및 고찰
그림 1은 플레이크형 Cu 입자 상에 Ni과 Ag를 연이어 무전해 도금한 경우 Ni 도금욕의 종류에 따른 입자 외형을 저배율 및 고배율의 주사전자현미경 이미지로 촬영한 결과이다. 산성 도금욕, 알칼리성 도금욕, 그리고 hydrazine 도금욕을 사용한 모든 샘플의 경우에서 후속 Ag 도금이 무난히 진행되었으며, 그 결과 저배율 이미지에서 확인되듯이 모든 샘플에서 플레이크 입자들간의 응집을 억제시킬 수 있었다. 또한 모든 최종 입자 샘플들의 고배율 이미지에서 확인되듯이 정도의 차이는 있었지만 요철 형태의 표면이 관찰되었는데, Ni 도금 직후의 이미지와 비교해 볼 때 이는 Ag 도금의 결과로 분석되었다.

(a-c) Low- and (d-f) high-magnification SEM images of Cu@Ni@Ag flakes prepared by successive Ni and Ag electroless plating with different Ni bath-types: (a, d) acid bath, (b, e) alkaline bath, and (c, f) hydrazine-based bath.
그림 2는 Ni 도금욕의 종류에 따른 Cu@Ni@Ag 입자들의 단면 EDS 라인 프로파일(profile) 결과들이다. Ni 도금욕의 종류에 관계없이 3종의 입자 모두 Cu 입자 표면에 Ni코팅층과 Ag 코팅층이 생성되었음을 확연하게 관찰할 수 있었다. 이를 통해 2중 코어-쉘(shell) 구조의 입자들이 성공적으로 제조되었음을 확인하였다.

Cross-section SEM images and EDS line-profile results of Cu@Ni@Ag flakes prepared by successive Ni and Ag electroless plating with different Ni bath-types: (a) acid bath, (b) alkaline bath, and (c) hydrazine-based bath.
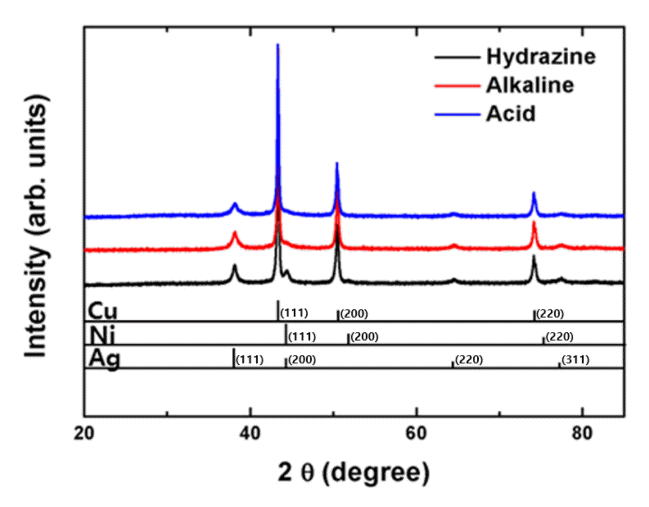
입자 코팅층들의 조성과 결정성을 검증하기 위해 실시한 3종 Cu@Ni@Ag 입자들의 XRD 측정 결과는 그림 3과 같았다. 순수 Cu, Ni, Ag 외에 어떠한 산화물 상도 검출되지 않아 Cu 입자의 전처리와 Ni 및 Ag 코팅층의 제조 과정 중에서 산화물의 잔존 및 생성은 거의 없는 것으로 분석되었다. 흥미로운 사실은, 산성 및 알칼리성 Ni 도금욕을 사용했던 시료에서는 비정질 Ni 코팅층의 형성으로 Ni 피크(peak)가 관찰되지 않았지만, hydrazine 도금욕을 사용한 시료에서는 결정성을 가지는 Ni 코팅층이 형성되면서 Ni 피크가 검출된 결과를 확인할 수 있었다. 산성 및 알칼리성 Ni 도금욕 사용 시 Ni 이온들이 환원되며 코팅층을 형성하는 반응은 각각 반응식 (1) 및 (2)와 같다 [24-27].
산성 및 알칼리성 Ni 도금욕에 환원제로 사용된 sodium hypophosphite는 아래와 같은 반응식 (3)에 의해 Ni이 환원되는 과정에서 반응 부산물로 인(P)이 함께 환원되면서 비정질의 Ni-P 코팅층을 형성한다 [28-29].
본 연구에서 산성 및 알칼리성 Ni 도금욕으로 인한 Ni 층 내 P 함량은 EDS 측정 시 각각 약 10 wt% 및 5 wt%로 측정되었다. 반면에 hydrazine 도금욕에서 발생하는 Ni의 환원반응은 반응식 (4)와 같으며, hydrazine 환원제에는 인이 없어 별다른 반응 부산물의 생성 없이 순수한 Ni만 환원되며 코팅층을 형성한다. 결과적으로 이러한 순수 Ni 코팅층은 결정성을 띄며 Ni 피크를 생성시키는 것을 확인할 수 있었다.
한편, Ni 코팅층 위에 형성된 Ag 코팅층은 세 가지 샘플 모두에서 결정성을 나타내어 Ag 피크가 명확히 관찰되었다.
그림 4는 Ni 도금욕 종류에 따라 제조된 Cu@Ni@Ag 분말의 대기 중 TG-DSC 결과들을 Cu@Ag 분말의 결과와 비교하여 제시한 것이다. 실선으로 나타낸 곡선은 온도에 따른 무게 변화를, 점선으로 나타낸 곡선은 온도에 따른 열출입 결과를 각각 나타낸다. Ni 층이 게재되지 않은 Cu@Ag 분말의 경우(그림 4(a)) TG 곡선에서 산화에 의한 무게 증가가 본격적으로 시작되는 온도, 즉, 산화 온도는 278.5°C로 측정되었다. 반면 산성 도금욕에서 제조된 분말의 경우(그림 4(b)) TG 곡선에서의 산화 온도는 313.4°C로 측정되었으며, 산화에 따른 발열 피크도 이 온도 부근에서부터 시작됨을 DSC 결과로부터 관찰할 수 있었다. 따라서 2중 코팅에 의한 다소간의 내산화성 개선이 관찰되었으나, 이는 자체 평가해본 Cu@Ni 분말에서의 산화 온도값과 거의 유사한 수준이었다. 반면 알칼리성 도금욕으로부터 제조된 분말의 경우(그림 4(c)) TG 곡선 상산화 온도가 477.3°C로 크게 상향되었으며, DSC 상 발열 거동도 유사 온도에서 시작되어 500°C 남짓한 온도에서 피크를 형성하였다. 따라서 알칼리성 Ni 도금욕을 사용한 Cu@Ni@Ag 분말에서는 확연히 우수한 내산화 특성을 확보할 수 있었다. 마지막으로 hydrazine 도금욕을 사용한 분말의 경우(그림 4(d))는 TG 상 산화 온도가 485.1°C로 가장 높게 측정되었으며, DSC 피크 또한 500°C가 넘는 가장 높은 온도에서 피크를 형성하였다. 결론적으로 hydrazine Ni 도금욕을 사용한 Cu@Ni@Ag 분말에서 가장 우수한 내산화 특성이 관찰되었다.

TG-DSC results of (a) Cu@Ag flakes and (b-d) Cu@Ni@Ag flakes prepared with different Ni bath-types: (b) acid bath, (c) alkaline bath, and (d) hydrazine-based bath.
상기 무게 증가 및 DSC 발열 피크의 형성 원인이 산화임을 증빙하기 위하여 각 분말을 350°C부터 최종 가열 온도인 600°C까지 50°C 간격으로 열처리를 실시한 다음 XRD 분석을 실시한 결과를 그림 5로 정리하였다. 산성 Ni 도금욕을 이용하여 제조된 분말의 경우(그림 5(a)), 이미 350°C부터 Cu2O 상이 생성되는 것을 확인할 수 있었다. 그림 4(b) TG 결과에서 산화 온도가 313.4°C였던 것을 고려하면 언급된 무게 증가는 코어 Cu의 산화에 의한 결과임을 알 수 있다. 한편 순수 Ni 피크도 미약하나마 검출되는 것이 확인되는데, 이는 비정질이었던 Ni 코팅층이 350°C로 가열되는 과정에서 결정화가 일어나면서 Ni 피크로 검출되는 것으로 분석되었다. 동시에 Ni 무전해 도금 시 Ni 층에 혼입되었던 P도 Ni3P의 결정상으로 전이된 결과를 발견할 수 있었다 [30-34]. 이후 450°C로 가열된 분말에서는 고온 산화상인 CuO가 생성되었고, 500°C 가열 시에는 CuO 상 피크의 세기가 Cu2O 피크의 세기를 넘어서는 결과를 확인할 수 있었다. 결국 550°C 가열 시 순수 Cu 피크의 세기는 크게 감소되는 결과가 확인되었으며, Ni 층의 일부도 NiO로 산화되는 거동이 관찰되었다. 또한 Ag 상 피크의 경우 350∼550°C의 범위에서 그 세기 증가가 점진적으로 진행되다 600°C에 이르러 Ag3PO4 상으로 전이되는 결과를 관찰할 수 있었다 [35]. 특히 600°C 가열 조건에서 존재하는 상들의 급격한 변화가 관찰되었는데, Cu, Cu2O, Ni 및 Ag 상들은 완전히 사라지고 CuO, NiO 및 Ag3PO4 상들이 존재하는 것을 확인하였다. 한편 가장 깊숙한 곳에 위치한 Cu의 산화 온도가 350°C임에 비해 외곽 Ni 층의 산화 온도가 550°C로 오히려 높은 것은 가열 과정에서 Ni과 Cu가 서로 혼합되는 결과로 해석된다. Cu와 Ni은 전율고용 양상의 상태도를 형성하기 때문에 [36], 생성된 Ni 층과 내부 Cu 코어는 가열 시 화합물 상의 생성 없이 점차 혼합되는 거동이 발생할 수 있다. 이 경우 Ni 층은 코팅층의 형태에서 고용 원소의 형태로 변형될 것이다.
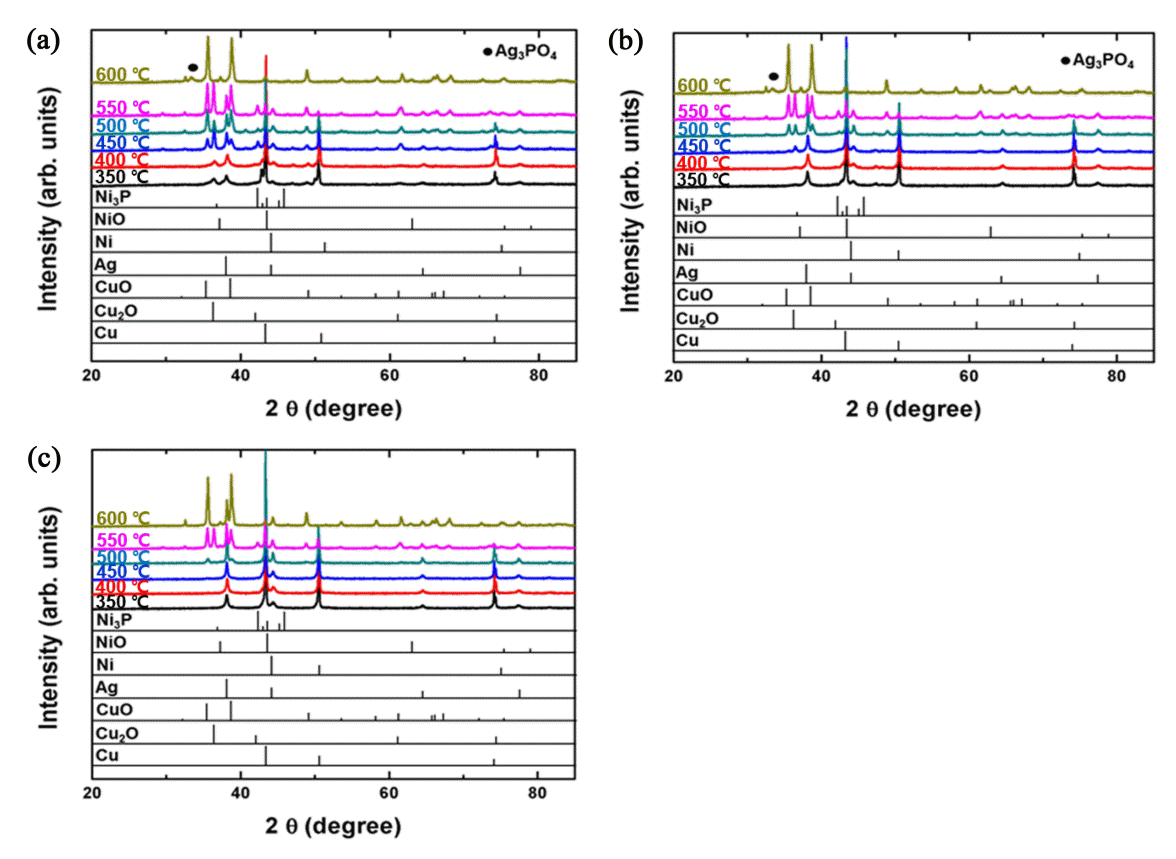
XRD patterns of Cu@Ni@Ag flakes prepared with different Ni bath-types at various annealing temperatures: (a) acid bath, (b) alkaline bath, and (c) hydrazine-based bath.
알칼리성 Ni 도금욕을 사용한 분말의 경우(그림 5(b)) 350°C로 가열하였을 때 Ni의 결정화에 따른 Ni 피크의 생성이 관찰되었으나, Cu2O 산화물상의 생성은 450°C로 이르러서야 관찰되는 결과가 확인되어 제조 입자의 월등한 내산화 특성을 확인할 수 있었다. 이는 산화 온도가 477.3°C이었던 그림 4(c)의 TG 결과와도 잘 일치한다. 이후 500°C로 가열함에 따라 CuO 상의 생성이 관찰되었고, 그 피크의 세기도 Cu2O 상 피크 수준임을 알 수 있었다. 550°C에서는 CuO 및 Cu2O의 세기가 함께 증가한 반면 Cu 상 피크의 세기는 크게 감소하여 Cu의 산화가 막바지로 접어듦을 확인할 수 있었다. 산성 도금욕 분말과 마찬가지로 Ag 상 피크의 세기는 350°C부터 550°C까지 서서히 증가하다 최종온도인 600°C에서 Ag3PO4 상으로 전이되는 결과를 확인할 수 있었다. 즉, 600°C 가열 시 Cu, Cu2O, Ni 및 Ag 상들은 존재하지 않고, CuO, NiO 및 Ag3PO4 상들만 존재함을 관찰할 수 있었다.
Hydrazine Ni 도금욕을 사용한 분말의 경우(그림 5(c)) 그림 3에서 언급했듯이 도금 직후부터 Ni 상 피크를 발견할 수 있었고, 이는 600°C 가열까지도 잔존하였다. Cu 산화물 피크는 무려 500°C에 이르러서야 관찰되었는데, 고온 조건으로 인하여 Cu2O 상 보다 CuO 상이 먼저 생성되는 결과가 확인되었다. 이는 Ag의 산화방지층이 450°C까지 대기 중 산소의 침투를 완벽히 막고 있다가 약 500°C에 이르러 결국 Ag 층의 dewetting 거동과 함께 Ni 층과 혼합된 Cu가 순간적으로 대기에 노출되면서 급격한 산화가 발생하여 Cu2O 상의 생성 없이 곧바로 CuO 상을 생성시킨 결과로 해석된다. 이후 550°C로 가열 온도가 증가하면 Cu2O 상이 뒤늦게 생성되는 결과가 관찰되었다. 한편 P가 함유되지 않는 Ni 도금으로 인해 600°C 가열 시에도 Ag3PO4 상의 형성 없이 순수 Ag 상이 CuO와 NiO 상과 함께 잔존하였다. 결론적으로 hydrazine Ni 도금욕을 사용한 Cu@Ni@Ag 입자가 가장 우수한 내산화 특성을 나타냄을 XRD 분석에서도 다시 한번 확인할 수 있었고데, 그 원인을 간접적으로 밝히기 위한 추가 분석이 이후 실시되었다.
고온 환경에서 Ag 코팅층의 거동을 확인하기 위해 Ni 도금욕의 종류에 따라 제조한 Cu@Ni@Ag 입자를 350∼550°C의 온도 범위에서 열처리시킨 다음 마운팅(mounting)하여 각 입자의 단면을 주사전자현미경의 후방산란전자(back-scattered electron, BSE) 모드로 관찰한 후 그림 6에 나타내었다. 모든 종류의 입자들에 대해 350°C 사진 기준으로 입자 최외곽의 밝은색 코팅층은 원자번호가 가장 높은 Ag 쉘 영역이다. 산성 Ni 도금욕을 사용한 입자의 경우 350°C에서부터 쉘의 형태가 일정 두께 상태로 유지되지 않고 두께 편차가 발생하면서 Ag dewetting이 일어난 것을 관찰할 수 있었다. 앞서 그림 5(a)에서 350°C부터 Cu 산화가 관찰됨을 고려할 때, 350°C까지의 과열 가정에서 Cu는 Ni-P 코팅층과 혼합되고, 이후 Ag dewetting이 일어나면서 얇은 Ag 쉘 부분을 통해 내부 Cu가 최외곽으로 추가 확산하여 대기에 노출되면 Cu2O 상이 생성되는 것으로 해석된다 [22]. 따라서 350°C에서 관찰된 Ag dewetting 결과는 그림 4(b) 및 그림 5(a)에서 관찰된 350°C 부근에서의 Cu 산화 결과를 잘 대변하였다. 한편 350°C에서 Ag 쉘의 dewetting과 Cu의 산화가 관찰되었지만 이는 Cu@Ag 입자에서의 dewetting 및 산화 보고와 비교할 때 약 150°C 정도나 지연된 결과인데, 이는 생성시킨 Ni-P 층이 Cu에 비해 Ag 쉘과의 계면 불안정성을 감소시킴으로써 dewetting 현상을 지연시킨 것으로 해석된다. Ag 쉘에서 dewetting이 발생하면 Ag 쉘은 국부적으로 점차 입자 형태로 뭉쳐지는데 [4,6,7,9,11,14,19-21,37,38], 이 과정에서 매우 얇은 두께 수준으로 존재했던 Ag 쉘은 재결정 과정을 거치게 된다 [19]. 이러한 현상은 앞서 그림 5(a)에서 온도 증가에 따라 Ag 피크의 세기가 커지는 결과의 원인으로 작용하게 된다. 또한 Ag dewetting 부분을 자세히 관찰하면 일부 영역에서는 dewetting된 Ag 쉘보다 더 외곽쪽에 Cu가 존재하는 상태가 관찰되는데, 이는 앞서 설명된 얇은 Ag 쉘 부분을 통한 내부 Cu의 투과 확산 기구를 잘 증빙하고 있다 [22]. 이후 온도 증가에 따라 최외곽부로의 Cu 확산은 점차 심해지며 이에 dewetting되어 뭉쳐진 Ag 상들은 산화된 Cu 내부에 묻힌 조직 형태로 전이되었다. 이와 더불어 입자 내부는 공동(void)이 점차 성장하게 되는데, 550°C까지의 승온 상황에서 입자 내부는 결국 거대한 공동의 형성 상태로 변이되었다 [38].

Cross-section BSE images at high temperatures of Cu@Ni@Ag flakes prepared with different Ni bath-types.
알칼리성 Ni 도금욕에서 제조한 입자의 경우 350°C까지는 일부 입자에서만 Ag dewetting이 시작되는 것이 관찰되었으나, 대부분의 입자들에서는 Ag 쉘의 형태가 유지되고 있었다. 따라서 이 온도에서 코어 Cu의 산화는 미미할 것으로 예측된다. 그러나 450°C까지 온도가 증가하게 되면 대부분의 입자들에서 Ag dewetting이 발생하였고, 따라서 Ni-P 코팅층과 혼합된 코어 Cu의 일부가 dewetting된 Ag 상들을 추월한 위치까지 외곽 확산한 조직들도 관찰되었다. 따라서 미세조직적으로 450°C에서의 Cu 산화는 불가피할 것으로 예상되는데, 이는 앞서 그림 4(c) 및 그림 5(b)에서의 관찰 결과와 잘 일치한다. 이후 550°C로 가열된 입자들은 산화된 구리층의 대부분이 dewetting된 Ag 상 외곽에 분포하는 조직들과 함께 그 내부는 거대한 공동으로 변화된 단면 조직들이 관찰되었다. 일부 입자들의 경우 속인빈 산화물 입자 내에 Cu 코어 입자가 방울 형태로 존재하는 것이 관찰되었는데, 이러한 방울부는 아직 산화되지 않은 Cu 상으로 사료된다.
Hydrazine Ni 도금욕을 사용한 입자의 경우, 350°C에서는 Ag dewetting 현상이 관찰되지 않았고, 450°C까지 가열 시 일부 입자에서부터 Ag dewetting이 진행되고 있는 상태가 확인되었다. 이후 550°C에 이르렀을 때 dewetting된 Ag 상들과 이를 덮고 있는 Cu 산화물상의 입자 외곽 조직들과 함께 공동이 형성된 입자 내부 조직들이 관찰되었는데, 앞서와는 달리 완전히 속이 빈 산화물 입자는 관찰하기 힘들었다. 즉, 대부분의 산화물 입자들 내에는 Cu 코어들이 존재하는 조직이 관찰되었다. 결론적으로 미세조직적 분석으로부터 450°C를 지나며부터 Cu 산화가 집중적으로 발생할 수 있는 상황임을 관찰할 수 있었으며, 이는 앞서 그림 4(d) 및 그림 5(c)에서의 관찰 결과와 잘 일치한다. 결과적으로 온도에 다른 단면 미세조직 관찰에서도 hydrazine Ni 도금욕으로 제조한 Cu@Ni@Ag 입자의 내산화 특성이 가장 우수할 것으로 분석되었으며, 이는 Ag dewetting이 보다 높은 온도에서 발생하는 원인 때문이다.
Ag dewetting의 시작 온도를 좌우하는 근본 원인이 Ni 코팅층의 결정성 차이인지를 살펴보기 위하여 가열 온도에 따른 Ag/Ni 코팅 Cu 플레이크의 XRD 결과 중 Ni(111) 피크 부분을 확대하여 그림 7로 정리하였다. 가열 온도가 증가함에 따라 피크의 세기가 변화되는 양상을 명확히 확인할 수 있었는데, 저온에서는 hydrazine 도금욕 처리 분말에서만 Ni 피크가 관찰되었으나 약 350°C부터 산성 도금욕과 알칼리성 도금욕 처리 분말에서도 비정질로 인해 관찰되지 않던 Ni 피크가 형성되는 결과를 확인할 수 있었다. 이에 따른 피크의 세기는 hydrazine 도금욕, 알칼리성 도금욕, 산성 도금욕 처리 분말의 순서로 높은 것을 알 수 있었는데, 이는 Ni 코팅층 내 존재하는 P의 함량에 따른 결과로 사료된다. 즉, hydrazine 도금욕을 사용하는 경우에서는 Ni 층 내 P의 함량이 0 wt%이지만, 알칼리성 도금욕 및 산성 도금욕을 사용한 경우의 P 함량은 각각 약 5 wt% 및 10 wt%여서 산성 도금욕을 사용 시 가장 높은 P 함량을 나타내었다. 높은 P 함량은 Ni 코팅층의 비정질 정도에 영향을 미칠 뿐 아니라, 열처리 시 결정화 속도에도 영향을 미치게 된다. 즉, Ni 층 내 P 원자의 함량이 높을수록 비정질 정도가 높아지고, 이후 열처리 등에 의한 결정화 속도 또한 느려진다는 사실이 보고된 바 있다 [39,40]. 따라서 본 연구에서 비교한 Ni 도금욕들로부터 유발되는 Ni 층 내 P 함량의 차이는 Ni 층의 결정화도 및 결정화 속도를 변화시키며, 이는 Ag 쉘과의의 계면에너지 등에 영향을 미쳐 궁극적으로 Ag dewetting 온도를 변화시키는 것으로 사료된다 [13,14,41-45].

For the three-type Cu@Ni@Ag flakes heated at different temperatures, XRD patterns being magnified in range of 44-45°: (a) 100°C, (b) 200°C, (c) 300°C, (d) 350°C, (e) 400°C, (f) 450°C, (g) 500°C, and (h) 550°C.
가열 온도에 따라 달라지는 Ni 층의 결정화도 및 코어 Cu와의 혼합 정도, 그리고 Ag 쉘의 dewetting 거동 등을 직관적 이미지를 통해 종합적으로 관찰하고자 그림 8∼10과 같이 3종의 Cu@Ni@Ag 플레이크 입자 단면을 온도에 따라 원소 맵핑(mapping)해 보았다. 산성 Ni 도금욕에서 제조한 입자의 온도별 단면 맵핑 이미지는 그림 8과 같다. 350°C로 가열했을 때 Ni 층과 Ag 층은 그 형태가 와해되고 있으며, Cu의 산화에 의해 O 맵핑 결과에서 입자들의 외곽부가 막 인식되기 시작하였다. P의 경우 Ni 코팅층에 함유되어 존재하므로, Ni 코팅층의 위치와 같은 위치에서 발견되는 것을 확인할 수 있었다. 450°C로 온도가 증가하면, 형성 Ni 층과 Cu 코어부와의 혼합이 더욱 진전되어 Ni은 입자 내부를 포함한 입자의 전부분에 걸쳐 존재하였으며, 이에 따라 P도 입자들의 전부분으로 확산된 결과가 관찰되었다. 아울러 Ag는 dewetting으로 쉘의 형태를 잃어버린 상황이었으며, Cu의 산화가 심하여 O 맵핑 결과에서 입자 외곽부의 산화는 명확히 관찰되었다. 이후 550°C까지 가열 시 Cu, Ni, P 및 Ag는 입자의 전 영역에 걸쳐 분포하였으며, O mapping 이미지에서의 산화에 의한 입자 외곽부 컨투어(contour)가 더욱 발달한 결과를 얻을 수 있었다.

EDS mapping images at different temperatures of Cu@Ni@Ag flakes prepared using the alkaline Ni bath.

EDS mapping images at different temperatures of Cu@Ni@Ag flakes prepared using the hydrazine-based Ni bath.
알칼리성 Ni 도금욕 적용에 의한 입자의 온도별 단면 맵핑 이미지는 그림 9에 나타내었다. 350°C 가열 시 Ni과 Ag 코팅층은 그 형태를 유지되고 있었으며, 이에 따라 O mapping 결과에서 산화에 대한 흔적을 발견할 수 없었다. P 또한 Ni 층 검출 위치에서 동일하게 검출되었다. 반면 450°C까지 가열한 경우 Ni과 Cu는 좀 더 혼합되었으며, Ag 쉘 형태도 다소 무너지고 있는 결과가 관찰되었다. 이에 O mapping 이미지에서 더 많은 산소가 검출되었으며, P도 Ni과 함께 입자 전 영역으로 확산되고 있는 상태가 관찰되었다. 이후 550°C로 입자를 가열할 경우 Cu, Ni, P 및 Ag는 입자의 전 영역에 분포하는 상태였으며, 입자 외곽의 산화층도 매우 발달된 상태임을 O mapping 이미지를 통해 알 수 있었다.
Hydrazine Ni 도금욕을 사용한 입자의 온도별 단면 SEM 이미지는 그림 10에 나타내었다. 이 입자들은 350°C부터 Ni 코팅층 구조가 무너지면서 Cu 코어부와의 혼합이 활발히 진행되었음을 알 수 있었는데, Ag 쉘은 그 형태를 유지하고 있어 입자들의 산화는 관찰되지 않았다. 또한 450°C까지 온도를 올렸을 경우 Ni과 Cu간의 혼합은 활발히 진행되었으나, Ag 쉘은 여전이 그 형태를 어느 정도 유지하여 입자들의 산화도 계속 억제되는 상태가 확인되었다. 그러나 550°C까지 승온할 경우 Ag 쉘의 dewetting이 급격히 진행된 상태를 확인할 수 있었으며, 이에 입자들의 산화에 의한 입자 외곽부에서의 O 검출 이미지가 확연히 관찰되었다.
이상의 결과들을 종합해 보았을 때, hydrazine Ni 도금욕을 통해 제조된 Cu@Ni@Ag 플레이크 입자에서 Ag dewetting의 억제가 가장 효과적이었으며, 이는 앞서 논의된 가장 높은 온도(약 500°C)에서의 산화 시작의 원인으로 작용하였다. Hydrazine 도금욕 Ni은 P가 없는 순수한 Ni 층이어서 다른 도금욕 입자 대비 가장 낮은 온도(약 300°C)에서부터 활발한 Cu와의 혼합 거동이 관찰되었다. 아울러 Cu-Ni 합금 조성 상에서의 Ag 쉘은 약 500°C까지도 dewetting이 억제되는 특성을 나타내었다. 따라서 Cu-Ni 합금 조성은 서론에서 언급된 여러 dewetting 원인들을 경감시키는 역할을 한 것으로 예측된다. 반면 산성 Ni 도금욕을 사용한 Cu@Ni@Ag 입자는 약 350°C부터 Ni 층의 결정화와 더불어 Ni 층 내 약 10 wt% P가 Ni3P 상으로 석출되는 거동이 관찰되었다. 이와 동시에 Ag 쉘은 dewetting을 일으키며 입자의 Cu 산화를 유발하였다. 따라서 Ni3P 상의 석출 거동이 Ag dewetting을 촉진시키는 주요 원인으로 파악되었는데, 이에 대해서는 보다 심도 있는 추가 연구가 필요하다. 한편 알칼리성 Ni 도금욕을 사용한 Cu@Ni@Ag 입자는 350°C에서 산성 도금욕 입자 대비 더 발달된 Ni 층 결정화 거동을 나타내었는데, 5 wt%의 P를 함유한 상태에서의 결정화는 Cu와의 혼합을 지연시켰으며, Ag 쉘은 Ni-P(-Cu)와 계면을 형성하며 약 450°C 근처까지 dewetting 억제 및 내산화성 특성을 나타내었다.
4. 결 론
Cu@Ag 입자에서의 Ag dewetting에 따른 200°C 부근 산화 특성을 개선시키기 위하여 Cu와 Ag 사이에 Ni 층을 삽입한 Cu@Ni@Ag 입자를 연속 무전해 도금법으로 제조하였고, 이때 Ni 도금욕의 종류에 따른 Ag dewetting 및 Cu 산화 거동의 변화 특성을 관찰하였다. 이를 통해 관찰 및 논의된 결과들은 다음과 같다.
1. 산성 Ni 도금욕으로 제조된 Ni 층은 약 10 wt%의 P를 함유하여 비정질 구조를 나타내었으며, 350°C로 가열 시 Ni3P 상이 형성되고 Ag 쉘의 dewetting이 발생하여 입자의 Cu 산화를 유발하였다. 이후 온도의 상승에 따라 Cu의 산화량이 증가했으며, 550°C에 이르러 Ni 산화물 상도 생성되는 한편 입자 내부에서는 조대한 공동이 형성되었다. 그리고 600°C에 이르러 Ag3PO4 상의 형성이 관찰되었다.
2. 알칼리성 Ni 도금욕으로 제조된 Ni 층은 약 5 wt%의 P를 함유하여 비정질 구조를 나타내었으며, 350°C에서 산성 도금욕 입자 대비 더 발달된 Ni 층 결정화 결과를 제공하였다. 결정화된 Ni-P 층은 Cu와의 혼합을 지연시켰으며, Ag 쉘은 Ni-P(-Cu) 상과 계면을 형성한 후 큰 dewetting 억제 특성을 발휘하여 약 450°C에 이르러서야 Ag dewetting 및 Cu의 산화가 발생하였다. 550°C에서 Ni의 산화 및 입자 내부에서의 조대한 공동 형성과 600°C에서 Ag3PO4 상 형성은 동일하였다.
3. Hydrazine Ni 도금욕으로 제조된 Ni 층은 도금 직후부터 P의 함유가 없는 결정질 Ni을 제공하였으며, 때문에 약 300°C부터 Cu 코어부와의 활발한 혼합 거동이 보여주었다. 형성된 Cu-Ni 합금 조성 상에서의 Ag 쉘은 약 500°C에 이르러서야 dewetting을 거동과 함께 Cu의 산화로 CuO 상을 형성시키며 가장 우수한 내산화 특성을 제공하였다.
따라서 알칼리성 및 hydrazine Ni 도금욕으로 제조된 Cu@Ni@Ag 입자는 대기 중 장시간 또는 고온 경화형 페이스트의 내산화 필러 소재 및 내산화성을 가지는 저가격형 우수 전기전도도 소재로서 그 적용이 기대된다.