
|
| ļ¬®ņĀü ļ░Å ļ▓öņ£ä Aims and Scope |
| ņĀĆļäÉ ņĀĢļ│┤ About the Journal |
| ĒÄĖņ¦æņ£äņøÉĒÜī Editorial Board |
| Open Access |
| ĒÄĖņ¦æĻĄŁ Editorial Office |


|
| ļ¬®ņĀü ļ░Å ļ▓öņ£ä Aims and Scope |
| ņĀĆļäÉ ņĀĢļ│┤ About the Journal |
| ĒÄĖņ¦æņ£äņøÉĒÜī Editorial Board |
| Open Access |
| ĒÄĖņ¦æĻĄŁ Editorial Office |

Cited By
Citations to this article as recorded by Engineering the catalyst layers towards enhanced local oxygen transport of Low-Pt proton exchange membrane fuel cells: Materials, designs, and methods
Shiqing Liu, Shu Yuan, Yuwei Liang, Huiyuan Li, Zhiling Xu, Qian Xu, Jiewei Yin, Shuiyun Shen, Xiaohui Yan, Junliang Zhang
International Journal of Hydrogen Energy.2023; 48(11): 4389. CrossRef Review of Electro-catalysts Supported by Metal Oxides for Electrochemical Oxygen Reduction Reaction
Yoo-Jin Jo, Won Suk Jung, Boyoung Lim
Korean Journal of Metals and Materials.2023; 61(4): 231. CrossRef AbstractDue to environmental pollution and global warming, research on new energy sources that can replace fossil fuels is important. A fuel cell is an eco-friendly energy conversion system that discharges water, and uses hydrogen as fuel. Although platinum is a widely used catalyst in PEMFCs, it has commercial limitations because of its low stability and high cost. Pt-based bimetal catalysts are being studied to improve performance and reduce the cost of fuel cell catalysts. Pt-M is excellent in terms of performance, stability, and cost, avoiding the disadvantages of the Pt catalyst. Studies on various bimetallic catalysts have been conducted, and among them, studies on Pt-Ni, Pt-Co, and Pt-Fe have been the most active. This review summarizes reports of fuel cell catalysts using Pt-M from 2014 to 2020. In recent studies, in order to improve the Pt-M performance, there have been attempts to change the pretreatment, the type of support, and the composition of Pt and M. There have also been studies that have applied new synthetic methods, which are different from traditional synthetic methods. Many Pt-M catalysts have shown better performance than commercial Pt/C, and exhibited stable performance in durability tests.
1. ņä£ ļĪĀņŚÉļäłņ¦Ć ņé¼ņÜ® ĻĖēņ”ØĻ│╝ ĒÖöņäØņŚ░ļŻīņØś Ļ│╝ļÅäĒĢ£ ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ ņ¦ĆĻĄ¼ ņś©ļé£ĒÖöņÖĆ ĒÖśĻ▓ĮņśżņŚ╝ņØś ņśüĒ¢źņ£╝ļĪ£ ĒÖśĻ▓Įņ╣£ĒÖöņĀü ņŚÉļäłņ¦Ć ņāØņé░ ļ░®ņŗØņØĖ ņŚ░ļŻīņĀäņ¦ĆņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ĒŖ╣Ē׳, Ļ│ĀļČäņ×É ņĀäĒĢ┤ņ¦ł ņŚ░ļŻīņĀäņ¦Ć(proton exchange membrane fuel cell, PEMFC)ļŖö ļ╣äĻĄÉņĀü ņĀĆņś©ņŚÉņä£ ņÜ┤ņĀä Ļ░ĆļŖźĒĢśļ®░ ņŚÉļäłņ¦Ć ļ│ĆĒÖś ĒÜ©ņ£©ņØ┤ ļåÆĻ│Ā, ņ£ĀĒĢ┤ Ļ░ĆņŖżļź╝ ļ░░ņČ£ĒĢśņ¦Ć ņĢŖļŖöļŗż. ņØ┤ļĪ£ ņØĖĒĢ┤ PEMFCļŖö ĒÖöņäØņŚ░ļŻīļź╝ ļīĆņ▓┤ĒĢĀ ņ▓ŁņĀĢ ņŚÉļäłņ¦Ć ļ░£ņĀäņ£╝ļĪ£ ņŻ╝ļ¬® ļ░øĻ│Ā ņ׳ļŗż [1,2].
ļ░▒ĻĖł(Pt)ņØĆ PEMFCņØś ņłśņåīņé░ĒÖöļ░śņØæ ļ░Å ņé░ņåīĒÖśņøÉļ░śņØæņŚÉ ļ¦żņÜ░ ļø░ņ¢┤ļé£ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä ļ│┤ņØĖļŗż [3,4]. ļśÉĒĢ£ ņĀäĻĖ░ņĀü ņĀäļÅäņä▒ņØ┤ ļø░ņ¢┤ļéśĻ│Ā ĒÖöĒĢÖņĀüņ£╝ļĪ£ ņĢłņĀĢĒĢśņŚ¼ ņĀäĻĖ░ĒÖöĒĢÖ ņ┤ēļ¦żļĪ£ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż. ņé░ņåīĒÖśņøÉļ░śņØæ(oxygen reduction reaction, ORR)ņØś ņåŹļÅäļŖö ņłśņåīņé░ĒÖöļ░śņØæ(hydrogen oxidation reaction, HOR)ņØś ņåŹļÅäņŚÉ ļ╣äĒĢ┤ ļ¦żņÜ░ ļŖÉļĀż PEMFCņØś ņĀäņ▓┤ ņä▒ļŖźņØä Ļ▓░ņĀĢĒĢ£ļŗż [5-8]. ĻĘĖļ¤¼ļéś PtļŖö ņ¦ĆĻĄ¼ ņāüņŚÉ ņåīļ¤ē ņĪ┤ņ×¼ĒĢśļŖö Ļ│ĀĻ░ĆņØś ĻĘĆĻĖłņåŹņØ┤ļŗż. ļśÉĒĢ£ ļé«ņØĆ pHņÖĆ Ļ│ĀņĀäņĢĢņŚÉņä£ ņÜ┤ņĀäļÉśļŖö PEMFCņØś ĒŖ╣ņä▒ņāü ĻĖłņåŹņØś ņĢłņĀĢņä▒ņŚÉ Ļ▓░ĒĢ©ņØ┤ ņāØĻĖ░ļ®░, ņØ┤ļĪ£ ņØĖĒĢ┤ ņ×ģņ×É Ēü¼ĻĖ░ņØś ņ”ØĻ░Ć [9], ņ¦Ćņ¦Ćņ▓┤ ĒāäņåīņØś ļČĆņŗØ [10], Pt ņÜ®ņČ£ [11] ļō▒ņØś ļ¼ĖņĀ£Ļ░Ć ļ░£ņāØĒĢ£ļŗż.
Pt ņ┤ēļ¦żņØś ļŗ©ņĀÉņØä ĒĢ┤Ļ▓░ĒĢśĻĖ░ ņ£äĒĢ£ ļīĆņĢł ņżæ ĒĢśļéśļŖö Ptļź╝ ņĀüņĀłĒĢ£ ņ¢æņØś ņĀäņØ┤ĻĖłņåŹ(M)Ļ│╝ ĒĢ®ĻĖłĒĢśļŖö Ļ▓āņØ┤ļŗż. ņ¦Ćļé£ ņłśņŗŁļģäĻ░ä ļ¦ÄņØĆ ņŚ░ĻĄ¼ņ×ÉļōżņØ┤ Pt-MņØä ĒĢ®ņä▒ĒĢśņŚ¼ ņ┤ēļ¦żņØś Ļ░ĆĻ▓®ņØä ļé«ņČöĻ│Ā ORRņŚÉ ļīĆĒĢ£ ĒÖ£ņä▒Ļ│╝ ļé┤ĻĄ¼ņä▒ņØä Ē¢źņāüņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ļŗżņ¢æĒĢ£ ņŗ£ļÅäļź╝ ĒĢśĻ│Ā ņ׳ļŗż. Pt-Ni [12], Pt-Co [13], Pt-Fe [14] ļō▒ņØś 3d ņĀäņØ┤ĻĖłņåŹ ĒĢ®ĻĖłņØ┤ ĻĘĖ ļīĆĒæ£ņĀüņØĖ ņśłņØ┤ļŗż.
ņØ┤ļ¤¼ĒĢ£ Pt-M ņ┤ēļ¦żņØś ĒÖ£ņä▒ņØĆ active area, Ēæ£ļ®┤ņØś ņøÉņ×ÉĻĄ¼ņĪ░, Ēü¼ĻĖ░, ĒśĢĒā£ ļō▒ņŚÉ ņśüĒ¢źņØä ļ░øļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖņ׳ļŗż [15]. ņØ┤ļĪ£ ņØĖĒĢ┤, Pt-Pt ņøÉņ×ÉĻ░ä Ļ▒░ļ”¼Ļ░Ć Ļ░ÉņåīĒĢśĻ│Ā, d-band centerņØś ņØ┤ļÅÖņ£╝ļĪ£ Pt-O ļ░Å O-O Ļ▓░ĒĢ®ņØä ņĢĮĒÖöņŗ£ņ╝£ ORR ĒÖ£ņä▒ņØä Ļ░£ņäĀĒĢĀ ņłś ņ׳ļŗż [2,3,16,17]. ļśÉĒĢ£, PtĻ│╝ ņĀäņØ┤ĻĖłņåŹņØś ņāüĒśĖņ×æņÜ®ņ£╝ļĪ£ ņŗ£ļäłņ¦Ć ĒÜ©Ļ│╝ļź╝ ņØ╝ņ£╝ĒéżĻ│Ā bi-functional ļ®öņ╗żļŗłņ”śņ£╝ļĪ£ ņØĖĒĢ┤ ņł£ņłśĒĢ£ Pt ņ┤ēļ¦żļ│┤ļŗż ņÜ░ņłśĒĢ£ ņĀäĻĖ░ĒÖöĒĢÖ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä ļ│┤ņØĖļŗż [18].
Pt-MņØś ņä▒ļŖźņØĆ ņ┤ēļ¦ż ņ¦Ćņ¦Ćņ▓┤ņØś ņóģļźśņŚÉ ņśüĒ¢źņØä ļ░øļŖöļŗż. ļåÆņØĆ Ēæ£ļ®┤ņĀü, ĒÖöĒĢÖņĀü ņĢłņĀĢņä▒Ļ│╝ ņÜ░ņłśĒĢ£ ņĀäļÅäņä▒ņØä Ļ░¢ļŖö Ēāäņåī ņ¦Ćņ¦Ćņ▓┤ļź╝ ņŻ╝ļĪ£ ņé¼ņÜ®ĒĢ£ļŗż [2,19-21]. ĒĢśņ¦Ćļ¦ī, PEMFC ņÜ┤ņĀä ņŗ£ņ×æĻ│╝ ļ®łņČż ņŗ£ Ēāäņåī ņ¦Ćņ¦Ćņ▓┤Ļ░Ć ļČĆņŗØļÉĀ ņłś ņ׳ļŗż. Ēāäņåī ņ¦Ćņ¦Ćņ▓┤Ļ░Ć ļČĆņŗØļÉ£ ņ┤ēļ¦żļŖö Pt ļśÉļŖö Pt-M ņ┤ēļ¦ż ņ×ģņ×ÉĻ░Ć ļČłņĢłņĀĢĒĢ£ ņāüĒā£ļĪ£ ļéśļēśņ¢┤ ļ¢©ņ¢┤ņĀĖ PEMFC ņä▒ļŖźņØä ņĀĆĒĢśņŗ£ĒéżļŖö Ļ▓░Ļ│╝ļź╝ Ļ░ĆņĀĖņś©ļŗż [22]. ņØ┤ļ¤¼ĒĢ£ ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśĻ│Āņ×É ņ¦łņåī ļō▒ņØś ņøÉņåīļź╝ ļÅäĒĢæĒĢ£ Ēāäņåī ņ¦Ćņ¦Ćņ▓┤ [23], ĻĘĖļלĒĢĆ [24], ņ╣┤ļ│Ė ļéśļģĖ ĒŖ£ļĖī [25] ļō▒ ļŗżņ¢æĒĢ£ ņ¦Ćņ¦Ćņ▓┤ Ļ┤ĆļĀ© ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż.
ņŚ┤ņ▓śļ”¼ļŖö ņ┤ēļ¦żņØś ņ×ģņ×É Ēü¼ĻĖ░, ļČäņé░ļÅä, ĒĢ®ĻĖłļÉśļŖö ņĀĢļÅä ļō▒ņØä ņĪ░ņĀłĒĢśĻ│Ā ņ¦Ćņ¦Ćņ▓┤ Ēæ£ļ®┤Ļ│╝ ĻĄ¼ņĪ░ ĒŖ╣ņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ│É ņ┤ēļ¦żņØś ņĢłņĀĢņä▒ņØä Ļ░£ņäĀĒĢĀ ņłś ņ׳ļŗż [26]. Chaisubanan ĻĘĖļŻ╣ņŚÉ ļö░ļź┤ļ®┤, Pt/C ņ┤ēļ¦żņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ Pt-M(M=Cr, Co, Pd) ņ┤ēļ¦żļŖö ņŚ┤ņ▓śļ”¼ Ēøä Pt-M Ļ▓░ņĀĢ ĻĄ¼ņĪ░Ļ░Ć ļ¦ÄņĢäņĪīĻ│Ā, Pt ņ×ģņ×ÉĻ░Ć ņØæņ¦æļÉśņ¢┤ ņĀäĻĖ░ ĒÖöĒĢÖ Ēæ£ļ®┤ņĀü(electrochemically active surface area, ECSA)ņØä Ļ░Éņåīņŗ£ņ╝░ļŗż [27]. ļśÉĒĢ£, ņŚ┤ņ▓śļ”¼ļŖö ņ┤ēļ¦żņØś ņĀäĻĖ░ ņĀäļÅäņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝░ņ£╝ļ®░ Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ Pt-M/C ņ┤ēļ¦żņØś ORR ĒÖ£ņä▒Ļ│╝ ņĢłņĀĢņä▒ Ļ░£ņäĀņŚÉ ņśüĒ¢źņØä ņŻ╝ņŚłļŗż.
ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ņĄ£ĻĘ╝ ņĢĮ 5ļģä ļé┤ņÖĖņŚÉ ļéśņś© Pt-M Ļ┤ĆļĀ© ļģ╝ļ¼ĖļōżņØä ņĀĢļ”¼ĒĢśņśĆļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ļ░öņØ┤ļ®öĒāł ņ┤ēļ¦żņØś ņä▒ļŖźņŚÉ ņĀäņØ┤ĻĖłņåŹņØ┤ ļ»Ėņ╣śļŖö ņśüĒ¢źĻ│╝ ĒĢ®ĻĖłņØś ļ®öņ╣┤ļŗłņ”ś, Pt-MņŚÉ ņĀüņÜ®ļÉ£ ļŗżņ¢æĒĢ£ ņŗ£ļÅä ļō▒ņØä ņĢīņĢäļ│┤ņĢśļŗż. ļŗżņ¢æĒĢ£ ļ░öņØ┤ļ®öĒāł Pt-M ņ┤ēļ¦ż ņżæņŚÉņä£ļÅä Pt-Ni, Pt-Co, Pt-FeĻ░Ć Ļ░Ćņן ļ¦ÄņØ┤ ņŚ░ĻĄ¼ļÉśņŚłņ£╝ļ®░, PtņÖĆ MņØś ļ╣äņ£©, ņŚ┤ņ▓śļ”¼ ņĪ░Ļ▒┤, ņ¦Ćņ¦Ćņ▓┤ļź╝ ļ│ĆĻ▓ĮĒĢśņŚ¼ ņ┤ēļ¦ż ņä▒ļŖźņØä ļåÆņØ┤ļŖö ņŚ░ĻĄ¼Ļ░Ć ļ¦ÄņĢśļŗż.
2. ļ│Ė ļĪĀ2.1 Pt-Ni ĒĢ®ĻĖłņ┤ēļ¦żPt-Ni ņ┤ēļ¦ż ĒĢ®ņä▒ņŚÉļŖö ņØ╝ļ░śņĀüņ£╝ļĪ£ ņŚ╝ĒÖöļŗłņ╝ł [18]ņØä ņĀäĻĄ¼ņ▓┤ļĪ£ ņé¼ņÜ®ĒĢśļ®░, ĻĘĖ ņÖĖņŚÉļÅä ļŗłņ╝ł(II) ņĢäņäĖĒŗĖņĢäņäĖĒåĀļäżņØ┤ĒŖĖ [1] ļō▒ņØä Ni ņĀäĻĄ¼ņ▓┤ļĪ£ ņØ┤ņÜ®ĒĢśļŖö ņŚ░ĻĄ¼ļōżņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż. Pt-Ni ņ┤ēļ¦żļŖö ļ®öĒāäņś¼ ņé░ĒÖö ļ░śņØæ(methanol oxidation reaction, MOR)Ļ│╝ ORR ļÅÖņ×æ ņĀäņ£äņŚÉņä£ņØś ņÜ®ņČ£ņØä Ļ░Éņåīņŗ£Ēéżļ®░, PtņØś Fermi energy ļĀłļ▓©ņØä Ļ░Éņåīņŗ£ņ╝£ Pt Ēæ£ļ®┤ņŚÉ COĻ░Ć ņēĮĻ▓ī ĒØĪņ░®ĒĢśņ¦Ć ļ¬╗ĒĢśĻ▓ī ĒĢśņŚ¼ ņ┤ēļ¦żņØś ņĢłņĀĢņä▒ņØä Ļ░£ņäĀĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż [28]. ĻĘĖļ¤¼ļéś, ņé░ņåī ņ╣£ĒÖöņä▒ ĻĖłņåŹņØ┤ Ļ│╝ĒĢśĻ▓ī ņĪ┤ņ×¼ĒĢĀ Ļ▓ĮņÜ░ PtņØś ĒÖ£ņä▒ ļČĆņ£äļź╝ Ļ░Éņåīņŗ£ņ╝£ ņ┤ēļ¦ż ņä▒ļŖźņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŗż. ļö░ļØ╝ņä£ ņé░ņåī ņ╣£ĒÖöņä▒ ĻĖłņåŹņØĆ Pt-M ņ┤ēļ¦żņŚÉ ņåīļ¤ē ļśÉļŖö ļ»Ėļ¤ē ņ▓©Ļ░ĆĒĢ┤ņĢ╝ĒĢ£ļŗż [29-31].
ļ¦ÄņØĆ ņŚ░ĻĄ¼ņ×ÉļōżņØ┤ Pt-NiņØś ņĄ£ņĀüņØś ĒĢ®ĻĖł ļ╣äņ£©ņØä ņ░ŠĻĖ░ ņ£äĒĢ£ ņŗżĒŚśņØä ĒĢśņśĆļŗż. PtxNi/C (x = 1, 2, 3, 5)ļź╝ ņĢīņ╣╝ļ”¼ ņĀäĒĢ┤ņ¦łņŚÉņä£ ņ┤ēļ¦ż ņä▒ļŖźņØä ņĖĪņĀĢĒĢ£ Ļ▓░Ļ│╝, ņĄ£ņĀüņØś ĒĢ®ĻĖł ļ╣äņ£©ņØĆ Pt:Ni=3:1ņØ┤ņŚłņ£╝ļ®░, Pt-Ni ĒĢ®ĻĖłņØ┤ ORR ļ░Å HER, HORņŚÉ ļīĆĒĢ£ ļ░śņØæ ņåŹļÅäļź╝ Ē¢źņāüņŗ£ĒéżļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż [32]. ņäĖĻ░Ćņ¦Ć ļŗżļźĖ ņøÉņ×Éļ╣ä(Pt:Ni = 1:4, 1.4:1, 2.8:1)ļĪ£ ĒĢ®ņä▒ĒĢ£ Pt-Ni ņ┤ēļ¦żļź╝ ļŗżņżæļ▓Į Ēāäņåī ļéśļģĖĒŖ£ļĖī(multi-walled carbon nanotubes, MWCNTs)ņŚÉ ļŗ┤ņ¦ĆĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö, Pt:NiņØś ņøÉņ×Éļ╣äĻ░Ć 1:2.8ņØ╝ļĢī ņĄ£ņĀüņØś ORR ĒÖ£ņä▒ņØä Ļ░ĆņĪīņ£╝ļ®░ ļ╣äĻĄÉņĀü ļåÆņØĆ ņøÉņ×Éļ╣ä(1:4)ļź╝ Ļ░¢ļŖö ĒĢ®ĻĖł ņ┤ēļ¦żņŚÉņä£ ļé«ņĢśļŗż [33].
ņĀäĒåĄņĀüņØĖ ĒĢ®ņä▒ļ▓ĢĻ│╝ļŖö ļŗżļźĖ ĒĢ®ņä▒ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ Pt:Ni ņĪ░ņä▒ņØä ļŗżļź┤Ļ▓ī ĒĢ£ ņŚ░ĻĄ¼ļÅä ņ׳ņŚłļŗż [34,35]. Ni-EDA Ēé¼ļĀłņØ┤ĒŖĖ ļ│ĄĒĢ®ņ▓┤ļĪ£ ņĀ£ņ×æĒĢ£ ņ¦Ćņ¦Ćņ▓┤(NCC)ņŚÉ Ptļź╝ ĒĢ©ņ╣©ĒĢśņŚ¼ Ļ░üĻ░üņØś ņĪ░ņä▒ņØ┤ Pt87Ni13, Pt93Ni7ņØĖ ņĮöņ¢┤-ņēś ĻĄ¼ņĪ░ņØś ņ┤ēļ¦ż PtNi/NCC-30, PtNi/NCC-50ņØä ĒĢ®ņä▒ĒĢśņśĆļŗż [34]. ņĀ£ņĪ░ļÉ£ ņ¦Ćņ¦Ćņ▓┤ņØś graphite planeņŚÉ ĒśĢņä▒ļÉ£ pyridinic-NĻ│╝ quaternary-NņØ┤ ORRņŚÉ ņ£Āļ”¼ĒĢ£ ņ×æņÜ®ņØä ĒĢśņśĆņ£╝ļ®░, ĒŖ╣Ē׳ pyridinic-NņØś ĒśĢņä▒ņ£╝ļĪ£ ņ╣┤ļ│ĖļĖöļ×ÖņŚÉ ļ╣äĒĢ┤ NCCļź╝ ņ¦Ćņ¦Ćņ▓┤ļĪ£ ņØ┤ņÜ®ĒĢ£ ņ┤ēļ¦żņØś ĒÖ£ņä▒ņØ┤ ļåÆņĢśļŗż. ĻĘĖļ”╝ 1ņŚÉ ļ│┤ņŚ¼ņ¦ä Ļ▓āĻ│╝ Ļ░ÖņØ┤, PtNi/NCC-30ņØś mass activityļŖö 0.44 A mgPtŌłÆ1ļĪ£, ņāüņÜ® Pt/C ļ│┤ļŗż ņĢĮ 3ļ░░ ļåÆņØĆ ĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. Magnetron co-sputteringļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņØ╝ļ░śņĀüņØĖ ĒÖöĒĢÖņĀü ĒÖśņøÉļ▓Ģ ļ│┤ļŗż Ļ░äļŗ©ĒĢśĻ│Ā ļ╣Āļź┤Ļ▓ī ĒĢ®ĻĖł ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢśļŖö ņŗ£ļÅäĻ░Ć ņ׳ņŚłļŗż [35]. ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ magnetronņØś ņĀäļĀźņØä ņĪ░ņĀłĒĢśņŚ¼ ņŚ¼ļ¤¼ ņĪ░ņä▒ņØś PtxNi100ŌłÆx (0 Ōēż x Ōēż 100)ņØä ņĀĢĒÖĢĒĢśĻ▓ī ņĀ£ņ¢┤ĒĢśņśĆĻ│Ā ļæÉĻ╗śņÖĆ Ļ▒░ņ╣ĀĻĖ░ļź╝ ļ╣äņŖĘĒĢ£ ņĀĢļÅäļĪ£ ņĪ░ņĀłĒĢśņśĆļŗż. ļČäņäØ Ļ▓░Ļ│╝ layerņŚÉņä£ņØś Ni ļåŹļÅäĻ░Ć 0-50%ņØ╝ ļĢī ECSAĻ░Ć ņÖäļ¦īĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśļŗżĻ░Ć 50% ņØ┤ņāüņŚÉņä£ ĻĖēĻ▓®ĒĢ£ ņ”ØĻ░Ćļź╝ ļ│┤ņśĆļŗż. ņØ┤Ļ▓āņØĆ NiņØ┤ 50% ņØ┤ņāüņØ╝ ļĢī ņ┤ēļ¦ż Ēæ£ļ®┤ņØś NiĻ░Ć ņÜ®ĒĢ┤ļÉśņ¢┤ Pt-skeleton ĻĄ¼ņĪ░Ļ░Ć ĒśĢņä▒ļÉśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. Pt-skeleton ĻĄ¼ņĪ░ļŖö Pt-MņŚÉņä£ ņĀäņØ┤ĻĖłņåŹņØ┤ ņÜ®ĒĢ┤ļÉśņ¢┤ ĒśĢņä▒ļÉ£ Pt Ēæ£ļ®┤ņ£╝ļĪ£, Pt-skin ĻĄ¼ņĪ░ņŚÉ ļ╣äĒĢ┤ ORR ĒÖ£ņä▒ņØ┤ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖņ׳ļŗż [36]. ĒĢ£ĒÄĖ, ļ¦īļōżņ¢┤ņ¦ä ņāśĒöīļōż ņżæņŚÉņä£ Pt25Ni75ņØś ņä▒ļŖźņØ┤ Ļ░Ćņן ņÜ░ņłśĒĢśņśĆļŗż.
Pt-Ni ņ┤ēļ¦żņØś ļ¬©ņ¢æņØä ņĪ░ņĀłĒĢśņŚ¼ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä Ļ░£ņäĀĒĢśĻ│Āņ×É ĒĢśļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņŚłļŗż. Gong ĻĘĖļŻ╣ņØĆ CTAC (cetyl trimethyl ammonium chloride)ņØś ņ¦łļ¤ēĻ│╝ ļ░śņØæņŗ£Ļ░äņØä ņĪ░ņĀłĒĢśņŚ¼ ĻĄÉņ░©ļÉ£ ņØ┤ņżæ ļŹżļ▓© ĒśĢĒā£ņØś ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢśņśĆļŗż [1]. CTACĻ░Ć ņäĀĒāØņĀüņ£╝ļĪ£ facetņØä cappingĒĢśļŖö Ļ▓āņØä ņØ┤ņÜ®ĒĢśņŚ¼ (100) facetņŚÉ PtĻ│╝ Ni ņøÉņ×ÉĻ░Ć ņ”Øņ░®ļÉśņ¢┤ branched structureļĪ£ ņä▒ņןĒĢśļŖö ļŗżļ®┤ņ▓┤ Pt-Ni ļéśļģĖņŗ£ĒŖĖļź╝ ĒśĢņä▒ĒĢśņśĆļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ĒĢ®ņä▒ļÉ£ PtŌĆōNi cross double dumbbell-like nanostructures (CDDNs)ļŖö ļŗ©Ļ▓░ņĀĢ ļŗżļ®┤ņ▓┤ļĪ£ņŹ©, Ēæ£ļ®┤ ņŚÉļäłņ¦Ćļź╝ ņĄ£ņåīĒÖöĒĢśņŚ¼ ņŚ┤ņŚŁĒĢÖņĀüņ£╝ļĪ£ ļ╣äĻĄÉņĀü ņĢłņĀĢĒĢśņśĆļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ĒĢ®ņä▒ĒĢ£ Pt-Ni ņ┤ēļ¦żņØś mass activityļŖö 3.02 A mgPtŌłÆ1ļĪ£ ņāüņÜ® Pt/Cļ│┤ļŗż 4.2ļ░░, If/Ib ratio (forward / backward peak current density)ļŖö 1.21ļĪ£ 3.5ļ░░ ļåÆņĢä ORRĻ│╝ MOR ņä▒ļŖźņØ┤ ņÜ░ņłśĒ¢łņ£╝ļ®░, CO Ēö╝ļÅģ ļé┤ņä▒ ļśÉĒĢ£ ņāüņÜ® Pt/CņŚÉ ļ╣äĒĢ┤ ņÜ░ņłśĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņä▒ļŖźņŚÉļŖö PtŌĆōNi CDDNsņØś ļŗżņżæ 2ņ░©ņøÉ ļéśļģĖņŗ£ĒŖĖ ĻĄ¼ņĪ░ļĪ£ ņØĖĒĢ£ ļäōņØĆ Ēæ£ļ®┤ņĀüĻ│╝ 3d ņĀäņØ┤ĻĖłņåŹĻ│╝ PtņØś ĒĢ®ĻĖłņØś ņāüņŖ╣ĒÜ©Ļ│╝Ļ░Ć ņśüĒ¢źņØä ņŻ╝ņŚłļŗż. Sievers ņŚ░ĻĄ¼ĒīĆņØĆ ļ▓żņĪ░ņé░ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ēīöļ®┤ņ▓┤ ĻĄ¼ņĪ░ņØś PtNi/Cļź╝ ĒĢ®ņä▒ĒĢśņśĆļŗż [37]. ņŗżĒŚśņŚÉņä£ ļ▓żņĪ░ņé░ņØś ļåŹļÅä, ļ░śņØæņś©ļÅä, ļ░śņØæņŗ£Ļ░äņØ┤ ņ┤ēļ¦ż ĻĄ¼ņĪ░ņŚÉ ņśüĒ¢źņØä ņŻ╝ņŚłļŗż. ņ┤ēļ¦żĻ░Ć Ēīöļ®┤ņ▓┤ ĻĄ¼ņĪ░ļź╝ ĒśĢņä▒ĒĢśļ®┤ ĒÖ£ņä▒ PtNi(111) ļ®┤ņØä Ēæ£ļ®┤ņŚÉ Ļ░Ćņ¦ĆĻ▓ī ļÉśņ¢┤ ORR ĒÖ£ņä▒ņØ┤ Ē¢źņāüļÉ£ļŗż. ņ┤ēļ¦żĻ░Ć Ēīöļ®┤ņ▓┤ ĻĄ¼ņĪ░ļź╝ ĒśĢņä▒ĒĢśļ®░ ļø░ņ¢┤ļé£ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä Ļ░Ćņ¦ĆĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņĀüņĀłĒĢ£ ļ░śņØæņś©ļÅä(160 ┬░C), ļ░śņØæņŗ£Ļ░ä(12 h), ļ▓żņĪ░ņé░ ļåŹļÅä(10 mM)Ļ░Ć ņżæņÜöĒĢśņśĆņ£╝ļ®░, ĒĢ┤ļŗ╣ņĪ░Ļ▒┤ņŚÉņä£ ĒĢ®ņä▒ļÉ£ ņ┤ēļ¦żņØś Ļ▓ĮņÜ░ mass, specific activityĻ░Ć Pt/Cļ│┤ļŗż Ļ░üĻ░ü 4.7ļ░░, 6.6ļ░░ ļåÆņĢśļŗż.
ņØ┤ņÖĖņŚÉļÅä ĒŖ╣ņĀĢĒĢ£ ņ▓śļ”¼ļź╝ ĒĢśĻ▒░ļéś ņ¦Ćņ¦Ćņ▓┤ļź╝ ļ│ĆĻ▓ĮĒĢśņŚ¼ ņ┤ēļ¦ż ņä▒ļŖźņØä Ļ░£ņäĀĒĢśĻĖ░ļÅä ĒĢśņśĆļŗż. PtņÖĆ NiņØś ļ¬░ļ╣äļź╝ 3:1ļĪ£ ņĪ░ņĀłĒĢśĻ│Ā self-etching(air-etching)Ļ│╝ acid-etchingņØä ĒĢśņŚ¼ Pt-Ni(trace)/GNsļź╝ ĒĢ®ņä▒ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, Pt-Ni(trace)/GNsņØś ņä▒ļŖźņØĆ ņŚÉņ╣ŁņØä ĒĢśņ¦Ć ņĢŖņØĆ Pt-Ni/GNsņŚÉ ļ╣äĒĢśņŚ¼ Ļ░£ņäĀļÉśņŚłļŗż [15]. Vulcan XC-72, CNTs, grapheneļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņ¦Ćņ¦Ćņ▓┤ņŚÉ ļö░ļźĖ Pt1Ni1 ņ┤ēļ¦ż ņä▒ļŖźņØä ņŚ░ĻĄ¼ĒĢ£ Ļ▓░Ļ│╝ņŚÉņä£ļŖö ĻĘĖļלĒĢĆņØä ņ¦Ćņ¦Ćņ▓┤ļĪ£ ņé¼ņÜ®ĒĢ£ ņ┤ēļ¦żĻ░Ć Ļ░Ćņן ņÜ░ņłśĒĢ£ ORR, MOR ņä▒ļŖźņØä ļ│┤ņśĆĻ│Ā Ļ│╝ņé░ĒÖöņłśņåīņØś ņłśņ£©ņØ┤ Ļ░Ćņן ļé«ņĢśļŗż [18]. ņØ┤ļ¤¼ĒĢ£ ņ┤ēļ¦żņØś ņä▒ļŖźņØĆ PtņÖĆ NiņØś ĒĢ®ĻĖłņ£╝ļĪ£ ņØĖĒĢ£ PtņÖĆ Ni ņé░ĒÖöļ¼╝ ņ”ØĻ░ĆļĪ£ ņØĖĒĢ£ Ļ▓āņØ┤ļŗż.
2.2 Pt-Co ĒĢ®ĻĖłņ┤ēļ¦żPt-M ņżæņŚÉņä£ Pt-CoļŖö Pt-FeņÖĆ ļŹöļČłņ¢┤ ļČĆņŗØņä▒Ļ│╝ ņ┤ēļ¦ż ĒÖ£ņä▒ņØ┤ ļåÆņØĆ ĻĘĖļŻ╣ņŚÉ ņåŹĒĢ£ļŗż [27]. Pt-CoļŖö ņé░ņä▒ ļ¦żņ¦łņŚÉņä£ ļåÆņØĆ ORR ĒÖ£ņä▒Ļ│╝ ņĢłņĀĢņä▒ņØä ļ│┤ņØ┤ļ®░, acid-leaching, annealing ļō▒ņØś ņ▓śļ”¼ Ēøä ļ¦īļōżņ¢┤ņ¦ä Pt-Co ņ┤ēļ¦żļōżņØĆ ņ┤ēļ¦ż ĒŖ╣ņä▒Ļ│╝ ņĢłņĀĢņä▒ņØ┤ Ļ░£ņäĀļÉśņŚłļŗż [41,42]. Pt-Co ņĀ£ņĪ░ ņŗ£ CoņØś ņĀäĻĄ¼ņ▓┤ļĪ£ ņé¼ņÜ®ļÉśļŖö ļ¼╝ņ¦łņØĆ ņŻ╝ļĪ£ ņ¦łņé░ ņĮöļ░£ĒŖĖ [2]ņØ┤ļ®░, ņØ┤ņÖĖņŚÉļÅä ņŚ╝ĒÖö ņĮöļ░£ĒŖĖ [27], ņĮöļ░£ĒŖĖ ņĢäņäĖĒģīņØ┤ĒŖĖ [43] ļō▒ņØ┤ ņé¼ņÜ®ļÉśņŚłļŗż.
ņĮöļ░£ĒŖĖ ņĢäņäĖĒģīņØ┤ĒŖĖ, ņŚ╝ĒÖö ņĮöļ░£ĒŖĖ ļō▒ņØś ļŗżļźĖ Co ņĀäĻĄ¼ņ▓┤ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢśļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ ņĮöļ░£ĒŖĖ ņĢäņäĖĒģīņØ┤ĒŖĖļź╝ ņé¼ņÜ®ĒĢ£ ņ┤ēļ¦żņØś ORR ņä▒ļŖźņØ┤ ļŹö ņÜ░ņłśĒĢśņśĆļŗż [43]. PtCo/C (C┬░Cl2)ņØś Ļ▓ĮņÜ░ PtCo/C (C4H6CoO4)ļ│┤ļŗż ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć ņ×æņĢśņ£╝ļéś ORR ņä▒ļŖźņØĆ ļ¢©ņ¢┤ņĪīļŖöļŹ░, ņØ┤ļŖö ClŌĆōĻ░Ć ORR ņä▒ļŖźņŚÉ ļČĆņĀĢņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣śĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.
ņé░ ņ▓śļ”¼ ļśÉļŖö ņŚ┤ņ▓śļ”¼Ļ░Ć Pt-Co ņ┤ēļ¦żņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņ׳ņŚłļŗż. ņŚ┤ņ▓śļ”¼ļŖö ņ┤ēļ¦żņØś ĒĢ®ĻĖł ņĀĢļÅä, ņĀäĻĖ░ ņĀäļÅäņä▒, ņĢłņĀĢņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝░ņ£╝ļéś, Pt ņ×ģņ×ÉĻ░Ć ņØæņ¦æļÉśņ¢┤ ECSAĻ░Ć Ļ░ÉņåīĒĢśņśĆļŗż [27]. 600-900 ┬░CņØś ļŗżļźĖ ņś©ļÅäņŚÉņä£ ņŚ┤ņ▓śļ”¼ļź╝ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ 800 ┬░CņŚÉņä£ ņŚ┤ņ▓śļ”¼ļź╝ ĒĢ£ PtCo/CCCS-800 ĒÖ£ņä▒ņØ┤ Ļ░Ćņן ņÜ░ņłśĒĢśņśĆļŖöļŹ░, ņØ┤ļŖö 800 ┬░CņŚÉņä£ņØś ņŚ┤ņ▓śļ”¼ļĪ£ ņØĖĒĢ┤ ļ®┤ņŗ¼ņĀĢļ░®ņĀĢ ĻĄ¼ņĪ░Ļ░Ć ĒśĢņä▒ļÉśņŚłĻĖ░ ļĢīļ¼ĖņØ┤ļŗż [17]. ļśÉ, ņŚ┤ņ▓śļ”¼ļź╝ 800 ┬░CņŚÉņä£ ņŚ┤ņ▓śļ”¼ ņ¦ĆņåŹ ņŗ£Ļ░äņØ┤ 2 ņŗ£Ļ░äĻ╣īņ¦Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ┤ēļ¦ż ņä▒ļŖźņŚÉ ĻĖŹņĀĢņĀüņØĖ ņśüĒ¢źņØä ņŻ╝ņŚłļŗż [44]. PtCo/NGCņØś mass activityļŖö ņŚ┤ņ▓śļ”¼ Ēøä 0.18 A mgPtŌłÆ1ņŚÉņä£ 0.45 A mgPtŌłÆ1ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņé░ ņ▓śļ”¼ Ēøä ņŚ┤ņ▓śļ”¼ĒĢ£ ņ┤ēļ¦ż(AL-PtCo/CN), ņé░ ņ▓śļ”¼ĒĢ£ ņ┤ēļ¦ż(L-PtCo/CN), PtCo/CN, ņāüņÜ® Pt/Cļź╝ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝, AL-PtCo/CNņØ┤ Ļ░ĆņåŹņŖżĒŖĖļĀłņŖżņŗ£ĒŚś ņØ┤Ēøä Ļ░Ćņן ņÜ░ņłśĒĢ£ ņĢłņĀĢņä▒ņØä ļ│┤ņśĆļŗż [45]. ņØ┤ļŖö ORRņŚÉ ļåÆņØĆ ļ░śņØæņä▒Ļ│╝ ņĀäĻĖ░ĒÖöĒĢÖņĀü ņÜ®ņČ£ņŚÉ ļåÆņØĆ ņĀĆĒĢŁņä▒ņØä ļ│┤ņØ┤ļŖö Pt(0)ņØś ĒĢ©ļ¤ēņŚÉ ļö░ļźĖ ļ│ĆĒÖöļĪ£ ļ│┤ņØĖļŗż. ĻĘĖļ”╝ 2ņŚÉ ļéśĒāĆļéĖ Ļ▓āĻ│╝ Ļ░ÖņØ┤, ņ┤łĻĖ░ PtCo ĒĢ®ĻĖłņØś Pt(0)ļŖö 68%ņŚÉ ņØ┤ļź┤ļĀĆņ£╝ļéś ņé░ ņ▓śļ”¼ Ļ│╝ņĀĢņØä Ļ▒░ņ╣£ Ēøä ņĢĮ 59%ņØś ļé«ņØĆ Pt(0) ĒĢ©ļ¤ēņØä ļ│┤ņśĆļŗż. ņØ┤Ēøä ņ×¼ ņŚ┤ņ▓śļ”¼ļź╝ ĒåĄĒĢ┤ 69%ļĪ£ ĒÜīļ│ĄĒĢ£ļŗż. ļ¬©ļōĀ Pt-Co ņ┤ēļ¦żļōżņØĆ Ļ░ĆņåŹņŖżĒŖĖļĀłņŖżņŗ£ĒŚś ņØ┤Ēøä ņāüņÜ® Pt/Cļ│┤ļŗż ņĢłņĀĢņĀüņØ┤ņŚłņ£╝ļéś L-PtCo/CNļŖö Pt(0) ļ╣äņ£© Ļ░Éņåī, Ēāäņåī ņ¦Ćņ¦Ćņ▓┤ ļČĆņŗØ, ĒÖ£ņä▒ļ¼╝ņ¦łĻ│╝ ņ¦Ćņ¦Ćņ▓┤ Ļ▓░ĒĢ®ļĀźņØś Ļ░ÉņåīļĪ£ ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņé░ ņ▓śļ”¼ņÖĆ ņŚ┤ņ▓śļ”¼ĒĢ£ ņ┤ēļ¦ż, ņŚ┤ņ▓śļ”¼ĒĢ£ ņ┤ēļ¦ż, ņé░ņ▓śļ”¼ĒĢ£ ņ┤ēļ¦żļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņé░ ņ▓śļ”¼ļź╝ ĒĢśņ¦Ć ņĢŖĻ▒░ļéś ņŚ┤ņ▓śļ”¼ļź╝ Ļ▒░ņ╣£ ņāśĒöīņØĆ ņ┤ēļ¦ż ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć ņ╗żņ¦ä Ļ▓░Ļ│╝ļĪ£ ņØĖĒĢ┤ ECSAĻ░Ć Ļ░ÉņåīĒĢśņśĆļŗż [43]. ļśÉĒĢ£, ņé░ ņ▓śļ”¼ļź╝ ĒĢ£ ņ┤ēļ¦żļŖö ņ┤ēļ¦ż Ēæ£ļ®┤ņŚÉņä£ CoĻ░Ć ņÖäņĀäĒ׳ ņĀ£Ļ▒░ļÉśņŚłņ£╝ļéś Co ņøÉņ×ÉĻ░Ć ņ┤ēļ¦żņØś Ļ▓░ņĀĢ ĻĄ¼ņĪ░ņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ņóŗņØĆ ņä▒ļŖźņØä ļ│┤ņśĆļŗż. ņé░ ņ▓śļ”¼ņÖĆ ņŚ┤ņ▓śļ”¼ļź╝ ļ¬©ļæÉ Ļ▒░ņ╣Ā Ļ▓ĮņÜ░ ņØ┤ņÖĆ Ļ░ÖņØĆ ņ▓śļ”¼ļź╝ ĒĢśņ¦Ć ņĢŖņØĆ ņ┤ēļ¦żļ│┤ļŗż ļåÆņØĆ ĒÖ£ņä▒Ļ│╝ ņĢłņĀĢņä▒ņØä ļ│┤ņØĖļŗż [41].
ĻĖ░ņĪ┤ ļ░®ņŗØĻ│╝ļŖö ļŗżļźĖ ĻĖ░ņłĀņØä ļÅäņ×ģĒĢśņŚ¼ Pt-Co ņ┤ēļ¦ż ņä▒ļŖźņØä Ļ░£ņäĀņŗ£ĒéżĻ│Āņ×É ĒĢśļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņŚłļŗż. Kumar ĻĘĖļŻ╣ņØĆ ņ┤łņØīĒīī ļ│┤ņĪ░ ĻĖ░ņłĀņØĖ sonochemical ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ ĻĘĀņØ╝ĒĢ£ ņ¦Ćļ”äņØä Ļ░Ćņ¦ä ļéśļģĖ ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢśņśĆļŗż [2]. Impregnation ļ░®ļ▓Ģņ£╝ļĪ£ ĒĢ®ņä▒ĒĢ£ Pt/C, Pt-Co/CņØś ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć Ļ░üĻ░ü 7.75 nmņÖĆ 7.39 nmņØĖļŹ░ ļ░śĒĢ┤, sonochemical ļ░®ļ▓Ģņ£╝ļĪ£ ĒĢ®ņä▒ĒĢ£ Pt/C, Pt-Co/C ņ┤ēļ¦żņØś ņ×ģņ×É Ēü¼ĻĖ░ļŖö 5 nm ņØ┤ĒĢśļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. Pt ĒīīņÜ░ļŹöņÖĆ Coļź╝ high energy ball millingņ£╝ļĪ£ ĒĢ®ĻĖłĒĢśņŚ¼ Co0.75Pt0.25ļź╝ ĒĢ®ņä▒ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ļ│╝ ļ░Ćļ¦üņØä 9ņŗ£Ļ░ä ĒĢ£ Co0.75Pt0.25/C-9h ņ┤ēļ¦żĻ░Ć ļåÆņØĆ ņĢłņĀĢņä▒Ļ│╝ ņ┤ēļ¦żĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż [39]. Co0.75Pt0.25/C-9hņŚÉļŖö CoOņÖĆ ZrOĻ░Ć ņĪ┤ņ×¼Ē¢łņ£╝ļ®░, ZrOļŖö ņ┤ēļ¦żņØś ņĢłņĀĢņä▒ņØä Ļ░£ņäĀĒĢśĻ│Ā Co ņé¼ņÜ®ĒĢśņśĆņØä ļĢī ļ░▒ĻĖł ņøÉņ×ÉņØś ņØæņ¦æņØä ņżäņśĆļŗż. Hu ĻĘĖļŻ╣ņØĆ PtCo nanorod assembles (NRAs)ņŚÉ ņłśņŚ┤ ņ▓śļ”¼ļź╝ ĒĢśņŚ¼ ļüØņØ┤ ļæźĻĖĆĻ│Ā ĻĖĖņØ┤Ļ░Ć ņ¦¦ņØĆ ņ┤łĻĘ╣ļ░Ģ ļéśļģĖļĪ£ļō£ļź╝ ĒĢ®ņä▒ĒĢśņśĆļŗż [46]. ĒāĆ ļģ╝ļ¼ĖļōżņŚÉņä£ ĒĢ®ņä▒ļÉ£ ļéśļģĖ ņÖĆņØ┤ņ¢┤Ļ░Ć low-index facetņØä Ļ░Ćņ¦ĆļŖö Ļ▓āņŚÉ ļ╣äĒĢ┤, NRAsļŖö high-index facetņØä Ļ░Ćņ¦äļŗż. ĻĘĖļ¤¼ļéś, high-index facetņØ┤ ņŚ┤ņŚŁĒĢÖņĀüņ£╝ļĪ£ ļČłņĢłņĀĢĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļéśļģĖņÖĆņØ┤ņ¢┤ ļ│ĄĒĢ®ņ▓┤(nanowire assembles, NWAs) ņĢłņŚÉ ņ׳ļŖö grain-boundariesļź╝ ļČĆņŗØņŗ£ņ╝£ ļéśļģĖņÖĆņØ┤ņ¢┤ļź╝ ļüŖņØīņ£╝ļĪ£ņä£ NRAsļź╝ ĒĢ®ņä▒ĒĢśņśĆļŗż. Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ PtCo NRAs/CļŖö PtCo NWAs/C, Pt NWAs/C, Pt/CņŚÉ ļ╣äĒĢ┤ ļø░ņ¢┤ļé£ ORR ĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. Batch Ļ│ĄņĀĢņØä ņāØļץĒĢśņŚ¼ ļ¦żņÜ░ ļé«ņØĆ Pt ļ¬░ļ╣ä(Pt:Co = 1:5)ļĪ£ ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢ£ Ļ▓░Ļ│╝ļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż [41]. ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒĢäĒä░ļ¦ü, ņøÉņŗ¼ļČäļ”¼, ņøīņŗ▒, Ļ▒┤ņĪ░, ņŚ┤ņ▓śļ”¼ ļō▒Ļ│╝ Ļ░ÖņØĆ batch Ļ│ĄņĀĢņØä ņāØļץĒĢśļŖö ĒÜ©ņ£©ņĀü ĒĢ®ņä▒ļ▓ĢņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ļ│╝ ļ░Ćļ¦üņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒĢ®ņä▒ĒĢ£ PtCo/CļŖö batch Ļ│ĄņĀĢņØä ļÅäņ×ģĒĢ£ ņ┤ēļ¦żņŚÉ ļ╣äĒĢ┤ ļé«ņØĆ ĒÖ£ņä▒ņØä ļ│┤ņśĆņ£╝ļéś in-situ ņĪ░Ļ▒┤ņŚÉņä£ ņāüņÜ® Pt/CņÖĆ ļ╣äņŖĘĒĢśĻ▒░ļéś ļéśņØĆ ņä▒ļŖźņØä ļ│┤ņśĆļŗż. ĻĘĖļ”╝ 3Ļ│╝ Ļ░ÖņØ┤, Pt/C ņ┤ēļ¦żņŚÉ Ļ│╝ļ¤ēņØś ņĀäņØ┤ĻĖłņåŹ ņŚ╝ņØä ĒĢ©ņ╣©ĒĢśļŖö ņØ╝ļ░śņĀüņØĖ ņŗżĒŚśļ▓ĢĻ│╝ ļŗ¼ļ”¼ CoņÖĆ N ņĀäĻĄ¼ņ▓┤ Ēś╝ĒĢ®ļ¼╝ņØä Ēāäņåī ņ¦Ćņ¦Ćņ▓┤ņŚÉ ļ©╝ņĀĆ ļÅäĒĢæĒĢ£ ļÆż Ptļź╝ ļŗ┤ņ¦ĆĒĢśļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņŚłļŗż [17,44,47]. NņØś ņ▓©Ļ░ĆļĪ£ ņØĖĒĢ┤ ņŚ┤ņ▓śļ”¼ Ēøä graphite planeņŚÉ pyridinic-NĻ│╝ quaternary-NņØ┤ ĒśĢņä▒ļÉśņŚłĻ│Ā, Pt ņ×ģņ×Éļź╝ ĻĘĀņØ╝ĒĢśĻ▓ī ĒĢ©ņ╣©ņŗ£ņ╝£ ORR ĒÖ£ņä▒ņŚÉ ņśüĒ¢źņØä ņŻ╝ņŚłļŗż. ĻĘĖļ”╝ 4ņØś Ļ▓░Ļ│╝ņÖĆ Ļ░ÖņØ┤ ņØ┤ļ¤¼ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ĒĢ®ņä▒ļÉ£ ņ┤ēļ¦żļōżņØĆ ĻĘ£ņ╣ÖņĀü ĻĄ¼ņĪ░ļź╝ Ļ░¢ļŖö ļ®┤ņŗ¼ņĀĢļ░®ņĀĢ PtCo ĻĄ¼ņĪ░ļĪ£ ņØĖĒĢ┤ ĻĖłņåŹņØś ņÜ®ĒĢ┤ļź╝ ļ░®ĒĢ┤ĒĢśņŚ¼ ĻĘĖļ”╝ 5ņØś Ļ▓░Ļ│╝ņÖĆ Ļ░ÖņØ┤ Ļ░ĆņåŹņŖżĒŖĖļĀłņŖżņŗ£ĒŚś ņóģļŻī Ēøä ļåÆņØĆ ņĢłņĀĢņä▒ņØä ļ│┤ņśĆļŗż.
2.3 Pt-Fe ĒĢ®ĻĖłņ┤ēļ¦żPt-FeņØĆ ļåÆņØĆ ņ┤ēļ¦ż ĒÖ£ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ Pt/Cļź╝ ļīĆņ▓┤ĒĢ£ ņ┤ēļ¦żļĪ£ņä£ ņŻ╝ļ¬®ļ░øņĢäņÖöļŗż. ĻĘĖļÅÖņĢł Pt-FeņØś Fe ņĀäĻĄ¼ņ▓┤ļĪ£ņä£ ņ¦łņé░ņ▓ĀņØ┤ Ļ░Ćņן ļäÉļ”¼ ņé¼ņÜ®ļÉśņ¢┤ņÖöņ£╝ļ®░ [48] ņ¦łņé░ņ▓Ā ņÖĖņŚÉļÅä ņŚ╝ĒÖöņ▓Ā [49], ĒÖ®ņé░ņ▓Ā [50], ĒÄśļĪ£ņä╝ [51] ļō▒ņØś ņĀäĻĄ¼ņ▓┤ļź╝ ņé¼ņÜ®ĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ļŗż.
ņ▓Ā ņĀäĻĄ¼ņ▓┤, ņŚ┤ņ▓śļ”¼ ņĪ░Ļ▒┤, PtņÖĆ FeņØś ļ╣äņ£©ņØ┤ ņ┤ēļ¦żņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņŚłļŗż. ņ¦łņé░ņ▓Ā ļśÉļŖö ņŚ┤ ņĢłņĀĢņä▒ņØ┤ ļåÆņØĆ ĻĄ¼ņŚ░ņé░ ņ▓Ā ņĢöļ¬©ļŖäņØä Fe ņĀäĻĄ¼ņ▓┤ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ Ļ░üĻ░ü PtFe/C-N, PtFe/C-Aļź╝ ĒĢ®ņä▒ĒĢ£ Ļ▓░Ļ│╝, PtFe/C-AļŖö PtFe/C-Nļ│┤ļŗż ņ┤ēļ¦ż ĒÖ£ņä▒Ļ│╝ ņĢłņĀĢņä▒ņØ┤ Ēü¼Ļ▓ī Ļ░£ņäĀļÉśņŚłļŗż [48]. Liu ļō▒ņØĆ ņ╣┤ļ│Ė ļéśļģĖ ņä¼ņ£Ā ņ¦Ćņ¦Ćņ▓┤ņŚÉ Pt-Feļź╝ ļŗ┤ņ¦ĆĒĢ£ FeŌĆōPt/CNFs ņ┤ēļ¦żļŖö ĒĢ®ņä▒ ņŗ£ ņŚ┤ņ▓śļ”¼ ņś©ļÅäļź╝ 500-1000 ┬░CļĪ£ ņĪ░ņĀĢĒĢśņśĆļŗż [51]. ļ¦īļōżņ¢┤ņ¦ä ņāśĒöī ņżæņŚÉņä£ 900 ┬░CņŚÉņä£ ņŚ┤ņ▓śļ”¼ĒĢ£ ņāśĒöīņØĖ FeŌĆōPt/CNFs-900ņØś ņ┤ēļ¦ż ņä▒ļŖźņØ┤ Ļ░Ćņן ņÜ░ņłśĒĢśņśĆņ£╝ļ®░ Ļ│╝ņé░ĒÖöņłśņåī ņłśņ£© ļśÉĒĢ£ ļé«ņĢśļŗż. ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ĻĘĖļŻ╣ņŚÉņä£ļŖö Pt1Fex(x = 1, 2, 3) ņ┤ēļ¦ż ĒĢ®ņä▒ĒĢĀ ļĢī, ņ┤ēļ¦ż Ēæ£ļ®┤ ņĪ░ņä▒ņŚÉ ļö░ļźĖ ņŚ┤ņ▓śļ”¼Ļ░Ć ORRņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņŚ░ĻĄ¼ĒĢśņśĆļŗż [49]. ņŚ┤ņ▓śļ”¼ļź╝ ĒĢśņ¦Ć ņĢŖņØĆ ņāśĒöīļōżņØś Ļ▓ĮņÜ░ Hupd ņśüņŚŁņØś ņĀäļźśļ░ĆļÅäĻ░Ć Pt1Fe3> Pt1Fe2 > Pt1Fe1 ņł£ņä£ļīĆļĪ£ ņ”ØĻ░ĆĒĢ£ ļ░śļ®┤, ņŚ┤ņ▓śļ”¼ Ēøä ORR ĒÖ£ņä▒ņØĆ Pt1Fe2 > Pt1Fe3 > Pt1Fe1 ņł£ņ£╝ļĪ£ Pt1Fe2ņØś ĒÖ£ņä▒ņØ┤ Ļ░Ćņן ļåÆņĢśļŗż. ņŚÉĒŗĖļĀī ĻĖĆļØ╝ņØ┤ņĮ£ ĒÖśņøÉļ▓ĢņØä ĒåĄĒĢ┤ PtņÖĆ FeņØä ļŗżĻ│Ąņä▒ Ēāäņåī ļéśļģĖņä¼ņ£Ā(porous carbon nanofiber, PCNF)ņŚÉ ļŗ┤ņ¦ĆĒĢ£ Pt4.8Fe/PCNF, Pt9.4Fe/PCNF, Pt6.1Fe/PCNFļź╝ pH7, pH9, pH11ņŚÉņä£ Ļ░üĻ░ü ĒĢ®ņä▒ĒĢ£ ņŚ░ĻĄ¼ļÅä ņ׳ņŚłļŗż [22]. PCNFļŖö ņĀäĻĖ░ļ░®ņé¼ļ▓ĢņØä ĒåĄĒĢ┤ ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ņØś ĻĖ░Ļ│Ą, Ļ▒░ņ╣£ Ēæ£ļ®┤, ļ¦ÄņØĆ Ļ▓░ĒĢ©ņØä Ļ░ĆņĪīļŗż. ņ┤ēļ¦żļōż ņżæ Pt4.8Fe/PCNFņØś Ļ░£ņŗ£ņĀäņ£äņÖĆ ļ░śĒīīņĀäņ£äļŖö Ļ░üĻ░ü 0.978, 0.824 VļĪ£, Pt/CņØś Ļ░Æ(0.96, 0.822 V)ļ│┤ļŗż ļåÆņØĆ ņä▒ļŖźņØä ļ│┤ņśĆļŗż. Wu ĻĘĖļŻ╣ņØĆ PtĻ│╝ Pt3Fe, PtFe3ņØä ļ╣äĻĄÉĒĢśņŚ¼ ļČäņäØĒĢśņŚ¼, PtņŚÉ ļ╣äĒĢ┤ Pt-FeņØś ĒÖ£ņä▒ņØ┤ ļåÆņØĆ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż [52]. Pt skin Ēæ£ļ®┤Ļ│╝ ĒØĪņ░®ļ¼╝(adsorbate) Ļ░äņØś ņāüĒśĖņ×æņÜ®ņØĆ Pt(111) > Pt-skinned Pt3Fe (111) > Pt-skinned PtFe3(111) ņł£ņ£╝ļĪ£ Ļ░ĢĒ¢łļŗż. ņé░ņåīĻ░Ć ĒØĪņ░®ĒĢśĻ│Ā ļ¼╝ ļČäņ×ÉĻ░Ć Ēāłņ░®ĒĢśļŖö 4ņĀäņ×É Ļ│╝ņĀĢņŚÉņä£, Pt-skinned PtFe3(111)ļŖö ņé░ņåī ĒØĪņ░®ņŚÉ ļīĆĒĢ┤ Ļ░Ćņן ļé«ņØĆ ĒÖ£ņä▒ĒÖö ņŚÉļäłņ¦Ćļź╝ ĒĢäņÜöļĪ£ Ē¢łĻ│Ā, ļ¼╝ ļČäņ×É Ēāłņ░®ņŚÉ ĒĢäņÜöĒĢ£ ņŚÉļäłņ¦Ć Ļ░ÆņØ┤ Ļ░Ćņן ļé«ņĢśļŗż. ņØ┤ļĪ£ ņØĖĒĢ┤, ļ¼╝ ļČäņ×ÉĻ░Ć Pt-skinned PtFe3(111) Ēæ£ļ®┤ņŚÉņä£ ņēĮĻ▓ī Ēāłņ░®ļÉśņ¢┤ ļŗżņØī ļ░śņØæņØä ļ╣Āļź┤Ļ▓ī ņØ┤ņ¢┤ļéśĻ░ł ņłś ņ׳ļŗż. Ļ▓░ļĪĀņĀüņ£╝ļĪ£ Fe ĒĢ©ļ¤ēņØ┤ ļŹö ļåÆņĢä ĒśĢņä▒ļÉśļŖö Pt-skinned PtFe3(111)ņØ┤ Pt-skinned Pt3Fe(111)ļ│┤ļŗż ļåÆņØĆ ĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. Ēāäņåīļź╝ PtFe ĒĢ®ĻĖł ņ┤ēļ¦żņŚÉ ņĮöĒīģĒĢśņŚ¼ ORRņŚÉ ļīĆĒĢ£ ļé┤ĻĄ¼ņä▒ņØä Ē¢źņāüņŗ£ĒéżļŖö ļģĖļĀźļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż [53]. ĒāäņåīĻ░Ć ĒÆŹļČĆĒĢ£ ļ”¼Ļ░äļō£ļź╝ ĒĢ©ņ£ĀĒĢ£ ĻĖłņåŹ ņĀäĻĄ¼ņ▓┤ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĒĢ®ĻĖł ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢśļ®░, ĻĘĖļ”╝ 6Ļ│╝ Ļ░ÖņØ┤ ļÅÖņŗ£ņŚÉ ņ¢ćņØĆ ĒāäņåīņĖĄņØ┤ ĒśĢņä▒ļÉśļŖö ĒśäņāüņØä ņ£ĀļÅäĒĢśņŚ¼ ņ┤ēļ¦żļź╝ ņĀ£ņĪ░ĒĢśņśĆļŗż. ļé┤ĻĄ¼ņä▒ ņŗ£ĒŚś ĒøäņŚÉ ņāüņÜ® Pt/CņØś ļ░śĒīī ņĀäņ£äĻ░ÆņØ┤ ņĢĮ 70 mV Ļ░ÉņåīĒĢ£ļŹ░ ļ░śĒĢ┤, ĒāäņåīņĖĄņØä ņĀüņÜ®ĒĢ£ ĒĢ®ĻĖł ņ┤ēļ¦żļŖö ņĢĮ 20-30 mV Ļ░ÉņåīĒĢ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ņāüņÜ® Pt/CņØś ECSAĻ░Ć ņĢĮ 60% Ļ░ÉņåīĒĢ£ Ļ▓āĻ│╝ ļŗ¼ļ”¼, ĒĢ®ĻĖł ņ┤ēļ¦żļŖö ļ¼┤ņŗ£ĒĢĀ ļ¦īĒĢ£ ļ│ĆĒÖöļ¦īņØ┤ Ļ┤ĆņĖĪļÉśņŚłļŗż.
ĻĘĖ ņÖĖņŚÉļÅä ņ£ĪĻ░üĒśĢņØś nanoplate Pt-M (M= Fe, Co, Ni)ļź╝ Ļ░äļŗ©ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ņĀ£ņĪ░ĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ׳ņŚłļŗż [40]. ĒĢ®ņä▒ļÉ£ PtFe ņ┤ēļ¦żļŖö ņĢĮ 2.6 nmņØś ņ£ĪĻ░üĒśĢ nanoplate ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłņ£╝ļ®░ Pt, PtCo, PtNiĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņé░ņä▒, ņŚ╝ĻĖ░ņä▒ ņĀäĒĢ┤ņ¦łņŚÉņä£ ņÜ░ņłśĒĢ£ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. ņŗżĒŚśņŚÉņä£ PtM ĒĢ®ņä▒ ņŗ£ Ēżļ”äņé░ņŚÉ ĻĖłņåŹ ņĀäĻĄ¼ņ▓┤ņØĖ ĻĖłņåŹņŚ╝ĒÖöļ¼╝ņØä ņÜ®ĒĢ┤ņŗ£ņ╝░ļŖöļŹ░, Ēżļ”äņé░ņØ┤ Ļ│╝ņĀäņ£äļź╝ ļé«Ļ▓ī ņ£Āņ¦ĆĒĢśĻ│Ā ņ┤ēļ¦ż Ēæ£ļ®┤ņŚÉ ņżæĻ░äņ▓┤ ņČĢņĀüņØä Ļ░Éņåīņŗ£ĒéżļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗżļŖö Ļ▓āņØ┤ ņØ┤ņĀä ņŚ░ĻĄ¼ [54]ņŚÉņä£ ņ×ģņ”ØļÉ£ ļ░ö ņ׳ļŗż. ĒøäĻĖ░ ņĀäņØ┤ ĻĖłņåŹņØĆ PtņŚÉ ļ╣äĒĢ┤ 5d vacancyņØä ļŹö ļ¦ÄņØ┤ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ vacancyļŖö O2 ĒØĪņ░®ņØä ļÅĢĻ│Ā O-O Ļ▓░ĒĢ®ņØĆ ņĢĮĒĢśĻ▓ī ĒĢśņŚ¼ O2 ļ░śņØæņåŹļÅäļź╝ ļåÆņØĖļŗż. FeļŖö Co, NiĻ│╝ Ļ░ÖņØĆ ĒøäĻĖ░ ņĀäņØ┤ ĻĖłņåŹņŚÉ ļ╣äĒĢ┤ 5d vacancyĻ░Ć ļŹö ļ¦ÄĻĖ░ ļĢīļ¼ĖņŚÉ ņ┤ēļ¦ż ņä▒ļŖźņØ┤ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż.
2.4 ĻĘĖņÖĖ Pt-M ĒĢ®ĻĖłņ┤ēļ¦żņĢ×ņäĀ Pt-Ni, Pt-Co, Pt-Fe ņÖĖņŚÉļÅä Pt-Sn [38,55,56], Pt-Cu [57,58], Pt-Pd [59,60], Pt-Ag [61,62], Pt-Cr [63], Pt-Mn [64], Pt-Au [65], Pt-B [66] ļō▒ņØś ļ░öņØ┤ļ®öĒāł ņ┤ēļ¦żĻ░Ć ņŚ░ĻĄ¼ļÉśņŚłļŗż. ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ PtņÖĆ MņØś ņĀüņĀłĒĢ£ ļ╣äņ£©ņØä ņ░ŠĻ▒░ļéś [56,60,62,63,66] ņ¦Ćņ¦Ćņ▓┤ [55,58,59,65,66] ļśÉļŖö ņŚ┤ņ▓śļ”¼ ņĪ░Ļ▒┤ [63]ņØä ļŗ¼ļ”¼ĒĢśļŖö ļō▒ņØś ļ░®ļ▓Ģņ£╝ļĪ£ ņ┤ēļ¦ż ņä▒ļŖźņØä Ļ░£ņäĀĒĢśņśĆļŗż.
Beyhan ĻĘĖļŻ╣ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, Pt-Sn/CņØĆ Pt-Ni/C, Pt-Sn-Ni/CņŚÉ ļ╣äĒĢ┤ ņĀäĻĖ░ĒÖöĒĢÖņĀü ņä▒ļŖźņØ┤ ņÜ░ņłśĒ¢łļŗż [38]. ņØ┤ļŖö Pt-Sn/CņŚÉņä£ ņĀüņĀłĒĢ£ ņ¢æņ£╝ļĪ£ ņĪ┤ņ×¼ĒĢśļŖö SnO2ļĪ£ ņØĖĒĢ┤ ļ¼╝Ļ│╝ ņé░ņåīņØś ĒØĪņ░®ņØ┤ ORRņŚÉ ņ£Āļ”¼ĒĢśĻ▓ī ņ×æņÜ®Ē¢łĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. 1-D Ēāäņåī ļéśļģĖĒŖ£ļĖīņÖĆ 2-D ĻĘĖļלĒĢĆ ĒĢśņØ┤ļĖīļ”¼ļō£ Ēāäņåī heterostructureļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļåÆņØĆ Ēæ£ļ®┤ņĀüĻ│╝ ņĀäĻĖ░ņĀäļÅäņä▒ņØ┤ ņÜ░ņłśĒĢ£ ņ¦Ćņ¦Ćņ▓┤ļź╝ ņé¼ņÜ®ĒĢ£ Pt-Sn/PCNTņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝Ļ░Ć ņåīĻ░£ļÉśņŚłļŗż [55]. PCNTļŖö ņ╣┤ļ│Ė ļéśļģĖ ĒŖ£ļĖīņŚÉ ļŹö ļ¦ÄņØĆ Ļ▓░ĒĢ©ņØä ļ¦īļōżņŚłĻ│Ā, ņØ┤ļ¤¼ĒĢ£ ņä▒ņ¦łņØĆ ņ╣┤ļ│Ė ļéśļģĖĒŖ£ļĖī Ļ│Āņ£ĀņØś ņןņĀÉĻ│╝ ļŹöļČłņ¢┤ ļ¦ÄņØĆ anchoring sitesļź╝ ņāØņä▒ĒĢśņŚ¼ ņ┤ēļ¦ż ņØ┤ņÜ®ļźĀņØä Ē¢źņāüņŗ£ņ╝░ļŗż. ļśÉĒĢ£ Pt-Sn/PCNTļŖö Pt-Sn/CNTņŚÉ ļ╣äĒĢ┤ ņŚÉĒāäņś¼ ņé░ĒÖö ļ░śņØæņŚÉņä£ņØś ņżæĻ░ä ņé░ļ¼╝ņØś ņ¢æņØ┤ ļŹö ņĀüņŚłļŗż. PtņÖĆ SnņØś ņ¦łļ¤ēļ╣äļź╝ 80/20(PtSn-A), 65/35(PtSn-B), 50/50(PtSn-C)ļĪ£ ļŗżļź┤Ļ▓ī ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśļŖö ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│Ā ļÉśņŚłļŗż [56]. Sn ĒĢ®ĻĖł ņŗ£ Sn ņé░ņåīĒĢ©ņ£ĀņóģņØś ĒśĢņä▒ņ£╝ļĪ£ ņé░ĒÖöļź╝ ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳Ļ│Ā ņØĖņĀæĒĢ£ PtņØś unoccupied d-bandļź╝ ļé«ņČ£ ņłś ņ׳ņŚłļŗż. SnņØś ĒĢ©ļ¤ēņØ┤ Ļ░Ćņן ļåÆņØĆ PtSn-CņØś ņ┤ēļ¦ż ĒÖ£ņä▒ņØ┤ Ļ░Ćņן ņÜ░ņłśĒĢśņśĆņ£╝ļéś, ņØīņĀäĒĢśņØś Sn ņé░ņåīĒĢ©ņ£ĀņóģņØ┤ ņ¢æņĀäĒĢśņØś Ptļź╝ ļüīņ¢┤ļŗ╣Ļ▓© Pt ļéśļģĖ ļĪ£ļō£ ĻĄ¼ņĪ░ļź╝ ĒīīĻ┤┤ĒĢśņŚ¼ ļé┤ĻĄ¼ņä▒ ņŗ£ĒŚśņŚÉņä£ ņĢłņĀĢņä▒ņØ┤ Ļ░Ćņן ļé«ņĢśļŗż. ļ░śļ®┤ņŚÉ, PtSn-AņŚÉņä£ 1-D Pt ļéśļģĖ ņÖĆņØ┤ņ¢┤ņØś ļåŹļÅäĻ░Ć Ļ░Ćņן ļåÆņĢśĻ│Ā ļé┤ĻĄ¼ņä▒ ņŗ£ĒŚśņŚÉņä£ Ļ░Ćņן ņÜ░ņłśĒĢ£ ņĢłņĀĢņä▒ņØä ļ│┤ņśĆļŗż.
ļŗżņ¢æĒĢ£ ņ¦Ćņ¦Ćņ▓┤ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Pt-Cu ņ┤ēļ¦żļź╝ ĒĢ®ņä▒ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│ĀļÉśņŚłļŗż [58]. ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ņ¦Ćņ¦Ćņ▓┤ļŖö ņ╣┤ļ│Ė ļéśļģĖ ņä¼ņ£Ā(CNFs), ļŗżņżæļ▓Į ĒāäņåīļéśļģĖĒŖ£ļĖī(MWCNTs), Vulcan XC72 ĒāäņåīņØ┤ļŗż. ĒĢ®ņä▒ļÉ£ ņ┤ēļ¦żļōżņØĆ Pt-Cu/CņÖĆ Pt/Cļ│┤ļŗż ņÜ░ņłśĒĢ£ CO ļé┤ņä▒ņØä Ļ░ĆņĪīņ£╝ļ®░, ņØ┤ļōż ņżæ CNFņÖĆ MWCNTņŚÉ ļŗ┤ņ¦ĆĒĢ£ Pt-Cu ĒĢ®ĻĖł ņ┤ēļ¦żĻ░Ć Ļ░üĻ░ü Ļ░Ćņן ļåÆņØĆ mass activityņÖĆ specific activityļź╝ ļ│┤ņśĆļŗż. ĻĘĖļ”¼Ļ│Ā ļæÉ ņ┤ēļ¦żļŖö PtņØś ņ¢æņØä 50% ņżäņŚ¼ ņé¼ņÜ®Ē¢łņØä Ļ▓ĮņÜ░ņŚÉļÅä ļåÆņØĆ ņĢłņĀĢņä▒ņØä ļ│┤ņśĆļŗż. Geboes ĻĘĖļŻ╣ņØĆ Ļ░łļ░öļŗē Ļ│ĄņĀĢņØä ĒżĒĢ©ĒĢ£ Ļ░äļŗ©ĒĢ£ 2 ļŗ©Ļ│ä ņŗżĒŚśļ▓Ģņ£╝ļĪ£ Pt-Cu/Cļź╝ ĒĢ®ņä▒Ē¢łļŗż [57]. Pt-CuņØś ļé«ņØĆ ļČäņé░ļÅäļĪ£ ņØĖĒĢ┤ Pt-Cu/CņØś ECSAĻ░ÆņØĆ ņāüņÜ® Pt/CņØś Ļ░Æļ│┤ļŗż ļé«ņĢśņ£╝ļéś ļ”¼Ļ░äļō£ ĒÜ©Ļ│╝ļĪ£ ņØĖĒĢ┤ specific activityļŖö ņāüņÜ® Pt/C ļ│┤ļŗż ļåÆņĢśļŗż.
CNTņØś ļČäņé░ļÅäĻ░Ć ņ┤ēļ¦żņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņŚ░ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ┤ ņØīņØ┤ņś©ņä▒ Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ņØĖ ļÅäļŹ░ņŗż ĒÖ®ņé░ ļéśĒŖĖļź©(SDS)ņÖĆ ņ¢æņØ┤ņś©ņä▒ Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ ņäĖĒŖĖļ”¼ļ¬©ļŖä ļĖīļĪ£ļ¦łņØ┤ļō£(CTAB)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Pt-Pd/CNT-SņÖĆ Pt-Pd/CNT-Cļź╝ Ļ░üĻ░ü ĒĢ®ņä▒ļÉśņŚłļŗż [59]. Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ļŖö Pt-PdņØś ņ×ģņ×É Ēü¼ĻĖ░ņŚÉļŖö ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśņ£╝ļéś MWCNTņØś ļČäņé░ņŚÉ ņśüĒ¢źņØä ņŻ╝ņŚłļŗż. ļæÉ Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ ņżæņŚÉņä£ ņØīņØ┤ņś©ņä▒ Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ņØś Ļ▓ĮņÜ░, MWCNT ļŗżļ░£ņØä ļČäņé░ņŗ£ĒéżĻ│Ā Pt-Pd ļéśļģĖņ×ģņ×Éļź╝ ĻĘĀņØ╝ĒĢśĻ▓ī ļČäņé░ņŗ£ĒéżļŖö Ļ▓āņØä ļÅäņÖöļŗż. ņ¢æņØ┤ņś©ņä▒ Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ņØś Ļ▓ĮņÜ░ņŚÉļŖö ļ░śļīĆļĪ£ MWCNT ļŗżļ░£Ļ│╝ ņ×ģņ×É ļČäņé░ņŚÉ ļÅäņøĆņØä ņŻ╝ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļ¤¼ĒĢ£ ņśüĒ¢źņØä ļ░öĒāĢņ£╝ļĪ£ Pt-Pd/CNT-SņØĆ ļåÆņØĆ ņĢłņĀĢņä▒Ļ│╝ ņ┤ēļ¦żĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. Pt-PdņØś Pt ņ¦łļ¤ēļ╣ä(1-7%)ņÖĆ PBI wt%(10-40 wt%)ļź╝ ņĪ░ņĀĢĒĢśņŚ¼ Pt-Pd/Cļź╝ ĒĢ®ņä▒ĒĢśņśĆņØä ļĢī, PBI 30 wt%ņØ┤Ļ│Ā Pt:PdņØś ņ¦łļ¤ēļ╣äĻ░Ć 5:95ņØĖ ņ┤ēļ¦żĻ░Ć Ļ░Ćņן ņóŗņØĆ ņ┤ēļ¦żĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż [60]. ņ¦Ćļéśņ╣śĻ▓ī ļåÆņØĆ PBI 40 wt%ļŖö ļ¦ÄņØĆ ņ¢æņØś ņżæĒĢ®ņ▓┤ļĪ£ ņØĖĒĢ┤ ļ░śņØæļ¼╝ ņØ┤ļÅÖņØä ņĀĆĒĢ┤ņŗ£ņ╝£ ņ┤ēļ¦ż ĒÖ£ņä▒ņØ┤ Ļ░Éņåīņŗ£ņ╝░ļŗż.
Ruiz-Camacho ĻĘĖļŻ╣ņØĆ sonochemical Ļ│ĄņĀĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ Pt-Ag/CņØä ĒĢ®ņä▒ĒĢśņśĆļŗż [61]. Pt/CņÖĆ Ag/Cļ│┤ļŗż ļø░ņ¢┤ļé£ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä ļ│┤ņśĆņ£╝ļ®░, ņé░ņä▒ ņĀäĒĢ┤ņ¦łņŚÉņä£ Pt/C ORR ņ┤ēļ¦ż ĒÖ£ņä▒ņØś 1.5ļ░░ ļåÆņØĆ ĒÖ£ņä▒ņØä ļ│┤ņśĆļŗż. AgņÖĆ PtņØś ļ╣äņ£©ņØä ņĪ░ņĀĢĒĢśņŚ¼ ņĮöņ¢┤-ņēś ĻĄ¼ņĪ░ņØś Ag@Pt/Cļź╝ ĒĢ®ņä▒ĒĢśņśĆļŗż [62]. ņŗżĒŚśĻ▓░Ļ│╝ Ag:PtņØś ņ¦łļ¤ēļ╣äĻ░Ć 1:1, 1:3, 1:9ņØĖ ņāśĒöīļōż ņżæ 1:3ņØś ņ¦łļ¤ēļ╣äļź╝ Ļ░Ćņ¦ä ņ┤ēļ¦żņØś ņ┤ēļ¦ż ĒÖ£ņä▒ņØ┤ Ļ░Ćņן ļø░ņ¢┤ļé¼ņ£╝ļ®░, ņØ┤ļŖö ņāüņÜ® Pt/CņØś Ļ░£ņŗ£ņĀäņ£ä(0.629 V)ļ│┤ļŗż ļåÆņØĆ Ļ░Æ(0.712 V)ņØä ļ│┤ņśĆļŗż.
PtņÖĆ CrņØś ņøÉņ×Éļ╣äļź╝ 1:1ņŚÉņä£ 5:1Ļ╣īņ¦Ć ņĪ░ņĀłĒĢśĻ│Ā ņŚ┤ņ▓śļ”¼ ņĪ░Ļ▒┤ņØä ļŗ¼ļ”¼ĒĢśņŚ¼ PtCr/Cļź╝ ĒĢ®ņä▒ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, PtņØś ņøÉņ×Éļ╣äĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ PtCrņØś ĒĢ®ĻĖłĒÖöļÅäļŖö ļé«ņĢäņĪīņ£╝ļ®░ ņØ┤ ņżæ Pt:CrĻ░Ć 3:1ņØĖ ņāśĒöīņØś ņ┤ēļ¦ż ĒÖ£ņä▒ņØ┤ Ļ░Ćņן ļø░ņ¢┤ļé¼ļŗż [63]. ņŚ┤ņ▓śļ”¼ļŖö ņ┤ēļ¦żņØś ņĢłņĀĢņä▒Ļ│╝ ĒĢ®ĻĖłĒÖö ņĀĢļÅä ļō▒ņŚÉ ņśüĒ¢źņØä ņŻ╝ņŚłļŖöļŹ░, ņ¦łņåī ļČäņ£äĻĖ░ņŚÉņä£ ņŚ┤ņ▓śļ”¼ ĒĢ£ ņ┤ēļ¦żņØś Ļ▓ĮņÜ░ ņ┤ēļ¦ż ņŚ┤ņ▓śļ”¼ ĒĢśņ¦Ć ņĢŖņØĆ ņ┤ēļ¦żņŚÉ ļ╣äĒĢ┤ ņĢłņĀĢņä▒Ļ│╝ ĒĢ®ĻĖłĒÖöļÅäĻ░Ć ņ”ØĻ░ĆĒĢśņśĆļŗż.
ņēśņØś ņøÉņ×ÉņĖĄ ņłśļź╝ 1, 1.5, 2ļĪ£ ņĪ░ņĀłĒĢśņŚ¼ ņĮöņ¢┤-ņēś ĻĄ¼ņĪ░ņØś Mn@Pt/Cļź╝ ĒĢ®ņä▒ĒĢ£ ņŚ░ĻĄ¼ļÅä ņ׳ņŚłļŗż [64]. CV ļŹ░ņØ┤Ēä░ļź╝ ĒåĄĒĢ┤ Mn ņĮöņ¢┤Ļ░Ć Pt ņēśņØś ņé░ņåī ņ╣£ĒÖöņä▒ņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓āĻ│╝ Pt ĒĢ©ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢĀ ļĢī ņ┤ēļ¦ż Ēæ£ļ®┤ņŚÉ ĒśĢņä▒ļÉ£ ņé░ĒÖöļ¼╝ņØś ņĢłņĀĢņä▒ņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļśÉĒĢ£ ļ¦īļōżņ¢┤ņ¦ä ņ┤ēļ¦ż ņżæņŚÉņä£ ņēśņØś ņøÉņ×ÉņĖĄ ņłśĻ░Ć 1.5ņØĖ ņāśĒöīņØś specific activityņÖĆ mass activityĻ░Ć Ļ░Ćņן ļåÆņĢśņ£╝ļ®░, ņēśņØś ņøÉņ×ÉņĖĄ ņłśĻ░Ć 2ņØĖ ņāśĒöīņØś ņĢłņĀĢņä▒ņØ┤ Ļ░Ćņן ļåÆņĢśļŗż. Mn@PtņØ┤ ļåÆņØĆ ORR ĒÖ£ņä▒ņØä ļ│┤ņØĖ ņøÉņØĖņØĆ MnņØś ņŚ┤ļ”░ ĻĄ¼ņĪ░ņÖĆ ņŚ░ņä▒ņØ┤ļ®░, Pt ņēśņØś ļæÉĻ╗śņŚÉ ļö░ļØ╝ Mn ņĮöņ¢┤ņØś ĻĄ¼ņĪ░ņĀü Ļ▓░ĒĢ©Ļ│╝ ņøÉņ×É ņČ®ņĀä ļ░ĆļÅäĻ░Ć ļŗ¼ļØ╝ņ¦äļŗż. ņØ┤ņŚÉ ļö░ļØ╝ Pt ņēśļÅä ņĢĢņČĢ, ļ│ĆĒśĢļÉśĻ│Ā Ēæ£ļ®┤ņŚÉ ņ׳ļŖö Pt ņé¼ņØ┤ĒŖĖņØś 5d-ņśżļ╣äĒāłņØ┤ 3D ņāüņŚÉņä£ ņä£ļĪ£ Ļ▓╣ņ╣śĻ▒░ļéś ļŗżļźĖ ļ░®Ē¢źņØä Ļ░ĆņĀĖ ļŗżļźĖ TM@PtņÖĆļŖö ļŗżļźĖ ORR ĒÖ£ņä▒ļÅäļź╝ ļ│┤ņØ╝ ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņśüĒ¢źņ£╝ļĪ£ O2ņØś Ļ▓░ĒĢ® ņŚÉļäłņ¦ĆĻ░Ć ļåÆņĢäņĀĖ OH, OOH ņóģņØś Ļ▓░ĒĢ® Ļ░ĢļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēéżņ¦Ć ņĢŖĻ│Ā ņé░ņåī Ļ░äņØś Ļ▓░ĒĢ®ņØä ļüŖņ¢┤ ORR ĒÜ©ņ£©ņØä ļåÆņØĖļŗż. ņĀ£ņØ╝ņøÉļ”¼ Ļ│äņé░ ļ░ĆļÅäļ▓öĒĢ©ņłś ņØ┤ļĪĀ(Density functional theory, DFT)ņŚÉ ĻĖ░ļ░śĒĢśņŚ¼ Pd1-xCux@Pd ņ£äņŚÉ Pt ļŗ©ņØ╝ņĖĄņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņ┤ēļ¦żņØś ĒÖ£ņä▒, d-band ņŚÉļäłņ¦Ć, ļ░śņØæņżæĻ░äļ¼╝ņØś Ļ▓░ĒĢ® ņŚÉļäłņ¦Ć ļō▒ņØä ļČäņäØĒĢ£ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ PdCu ĒĢ®ĻĖł ņĪ░ņä▒ņŚÉ ļö░ļźĖ ORRņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ļ│┤Ļ│ĀļÉśņśĆļŗż [67]. ĻĘĖļ”╝ 7ņŚÉņä£ ļ│┤ņØĖ Ļ▓āĻ│╝ Ļ░ÖņØ┤, d-band center ņŚÉļäłņ¦ĆņÖĆ ņ┤ēļ¦ż Ēæ£ļ®┤ņØś ļ░śņØæņä▒ ņé¼ņØ┤ņŚÉ ņäĀĒśĢņØś Ļ┤ĆĻ│äĻ░Ć ņĪ┤ņ×¼ĒĢ£ļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż. ņØ┤ļŖö ĒÄśļź┤ļ»Ė ņżĆņ£äņŚÉņä£ ļ©╝ d-band center ņŚÉļäłņ¦ĆņŚÉ ļīĆĒĢ┤ Ēæ£ļ®┤ņØś ļ░śņØæņä▒ņØ┤ ļ¢©ņ¢┤ņ¦äļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż. ņØ┤ņŚÉ ļö░ļØ╝ Pt/Pd/Pd0.875Cu0.125 ņ┤ēļ¦żĻ░Ć ļ░śņØæņä▒ņŚÉ ļīĆĒĢ┤ņä£ ņĄ£ņĀüņØś ņĪ░ņä▒ņØ┤ļØ╝Ļ│Ā ĒĢ£ļŗż.
ņŚŁ ļ¦łņØ┤Ēü¼ļĪ£ ņŚÉļ®ĆņĀ╝ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖśņøÉ ĻĘĖļלĒöĮ ņśźņé¼ņØ┤ļō£(rGO)ņŚÉ Pt-Auļź╝ ļŗ┤ņ¦ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│ĀļÉÉļŗż [65]. Pt/rGOņŚÉ ļ╣äĒĢ┤, Pt-Au/rGOļŖö 50,000 ņé¼ņØ┤Ēü┤ Ēøä ņ┤ēļ¦ż ņä▒ļŖźņØ┤ ļ¦żņÜ░ ņĢłņĀĢĒĢ©ņØä ļ│┤ņśĆļŗż. ĻĘĖļלĒĢĆ ņ¦Ćņ¦Ćņ▓┤ļŖö ņāØņä▒ļÉ£ H2OņØä ņĀ£Ļ▒░ĒĢśļŖöļŹ░ ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖĻ│Ā GDL ĻĄ¼ņĪ░ļŖö Ļ░ĆņŖż ĒÖĢņé░ņŚÉ ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņŖżĒÄśņØ┤ņä£ļź╝ ļÅäņ×ģĒĢśņśĆļŗż. ņŖżĒÄśņØ┤ņä£ņØś ļÅäņ×ģņØĆ GDLņØś ĻĄ¼ņĪ░, ņ┤ēļ¦ż ļČäņé░ļÅä, ņś┤ ņĀĆĒĢŁņØś Ļ░£ņäĀņŚÉ ļÅäņøĆņØä ņŻ╝ņŚłĻ│Ā ņŖżĒÄśņØ┤ņä£ļĪ£ņŹ© CNTņÖĆ Pt-Au/CNTĻ░Ć ņé¼ņÜ®ļÉśņŚłņØä ļĢī Pt-Au/rGO ņ┤ēļ¦żņØś ņĄ£ļīĆ ņĀäļĀź ļ░ĆļÅäĻ░Ć ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢśņśĆļŗż.
3. Ļ▓░ ļĪĀļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ņĄ£ĻĘ╝ ļ░£Ēæ£ļÉ£ ļ░▒ĻĖł ĻĖ░ļ░ś 2ņøÉ ĒĢ®ĻĖł ņ┤ēļ¦żļōżņØä ņåīĻ░£ĒĢśņśĆļŗż. Pt-MņØĆ Pt ņ┤ēļ¦żņŚÉ ļ╣äĒĢ┤ ļ╣äņŖĘĒĢśĻ▒░ļéś ļåÆņØĆ ņä▒ļŖźņØä ļ│┤ņśĆņ£╝ļ®░, ļé┤ĻĄ¼ņä▒Ļ│╝ ņĢłņĀĢņä▒ņØä Ļ░£ņäĀĒĢśņśĆļŗż. Pt-M ņżæ Pt-Ni, Pt-Fe, Pt-CoļŖö ORR Ļ│╝ņĀĢ ņżæ ņé░ņåī ĒØĪĒāłņ░®ņŚÉ ļīĆĒĢ£ ņé░ņåī Ļ▓░ĒĢ® ņŚÉļäłņ¦ĆĻ░Ć ņĀüņĀłĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļŗżļźĖ Pt-MņŚÉ ļ╣äĒĢ┤ ņÜ░ņłśĒĢ£ ņ┤ēļ¦ż ņä▒ļŖźņØä ļ│┤ņØĖ Ļ▓āņ£╝ļĪ£ ņÜöņĢĮĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļĪ£ ņØĖĒĢ┤, Pt-Ni, Pt-Fe, Pt-Ni ņ┤ēļ¦ż ĒĢ®ņä▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć Ļ░Ćņן ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņĪīņ£╝ļ®░, ĻĘĖ ņżæ Pt-Fe ņ┤ēļ¦żĻ░Ć Ļ░Ćņן ņÜ░ņłśĒĢ£ ņ┤ēļ¦ż ĒÖ£ņä▒ņØä Ļ░Ćņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ Pt-MņØś ļ╣äņ£©ņØä ņĪ░ņĀłĒĢśņŚ¼ ņĄ£ņĀüņØś ļ╣äņ£©ņØä ņ░ŠĻĖ░ ņ£äĒĢ┤ ļģĖļĀźĒĢśņśĆļŗż. Ni, Co, FeļŖö Ļ░üĻ░ü PtNi3, PtCo3, PtFe2, PtFe3ņØś ņøÉņ×Éļ╣äļź╝ Ļ░Ćņ¦ł ļĢī ņ┤ēļ¦ż ņä▒ļŖźņØ┤ Ļ░Ćņן ņÜ░ņłśĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØ┤ļ®░, ĻĘĖ ņÖĖņØś MņØś Ļ▓ĮņÜ░ Pt:MĻ░Ć PtSn(ņ¦łļ¤ēļ╣ä 1:1) PtPd(ņ¦łļ¤ēļ╣ä 5:95), PtAg(ņ¦łļ¤ēļ╣ä 3:1), Pt3Cr, PtB3 ņØ╝ ļĢī ņä▒ļŖźņØ┤ ņÜ░ņłśĒĢśņśĆļŗż.
Pt ļīĆ M ļ╣äņ£©ņØä ņĪ░ņĀłĒĢśļŖö ļ░®ļ▓Ģ ņÖĖņŚÉļÅä Pt-MņŚÉ ņ╣┤ļ│Ė ļĖöļ×Ö ņÖĖņØś ļŗżņ¢æĒĢ£ ņ¦Ćņ¦Ćņ▓┤(CNT, MWCNT, CNF, CNC, rGO, Gr ļō▒)ļź╝ ņĀüņÜ®ĒĢśĻ▒░ļéś ņĀäĻĄ¼ņ▓┤ ņóģļźś, ņé░ņ▓śļ”¼, ņŚ┤ņ▓śļ”¼ ņĪ░Ļ▒┤ņØä ļŗ¼ļ”¼ĒĢśļŖö ņŚ░ĻĄ¼ļōż, ņ┤ēļ¦żņØś ĻĄ¼ņĪ░ņÖĆ ĒśĢĒā£ļź╝ ņĪ░ņĀłĒĢśņŚ¼ ņä▒ļŖźņØä Ļ░£ņäĀņŗ£ĒéżļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņŚłļŗż.
AcknowledgmentsņØ┤ ņä▒Ļ│╝ļŖö ņĀĢļČĆ(Ļ│╝ĒĢÖĻĖ░ņłĀņĀĢļ│┤ĒåĄņŗĀļČĆ)ņØś ņ×¼ņøÉņ£╝ļĪ£ ĒĢ£ĻĄŁņŚ░ĻĄ¼ņ×¼ļŗ©ņØś ņ¦ĆņøÉņØä ļ░øņĢä ņłśĒ¢ēļÉ£ ņŚ░ĻĄ¼Ļ│╝ņĀ£(No. 2020R1C1C1004206)ņØ┤ļ®░, ņØ┤ņŚÉ Ļ░Éņé¼ļō£ļ”Įļŗłļŗż. ņĄ£ļ¬ģĒśĖĻĄ░ņØś ņ┤łĻĖ░ ņ×ÉļŻīņłśņ¦æ ļÅäņøĆņŚÉ Ļ░Éņé¼ļō£ļ”Įļŗłļŗż.
Fig.┬Ā1.PEMFC polarization and power density curves of (a) 30% Pt/NCC and 50% Pt/NCC catalysts, and (b) PtNi/NCC-30 and PtNi/NCC-50 as compared to commercial Pt/C catalysts at 80 ┬░C and 40% RH. (c) Comparison of mass activities and lattice parameters of PtNi/NCC-30, PtNi/NCC-50, and commercial Pt/C catalysts. Reprinted with permission from Ref. 34. Copyright (2018) Elsevier. 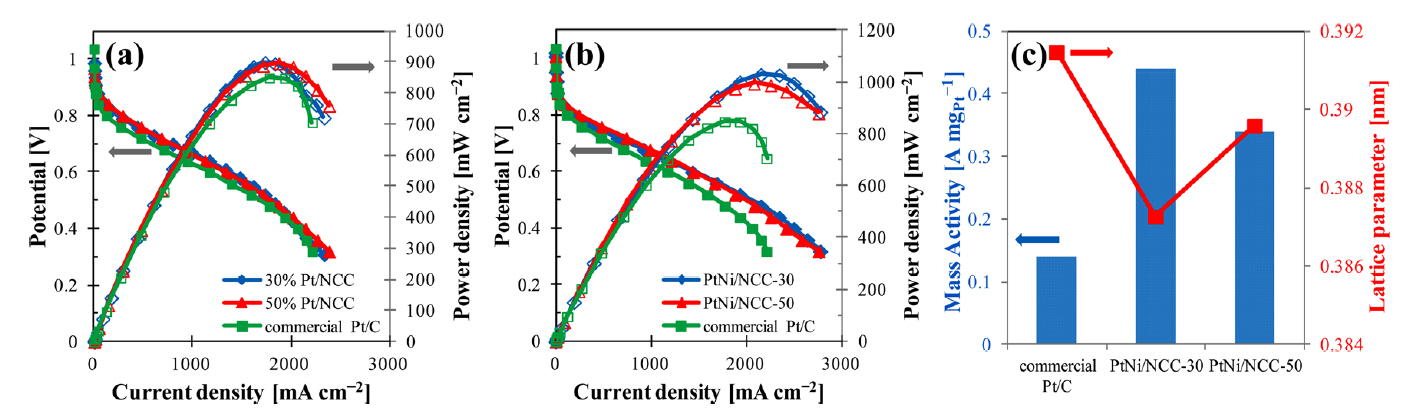
Fig.┬Ā2.Deconvoluted XPS spectra of Pt 4f in (a) PtCo/CN, (b) L-PtCo/CN, (c) AL-PtCo/CN, and (d) commercial Pt/C catalysts. Reprinted with permission from Ref. 45. Copyright (2017) American Chemical Society. 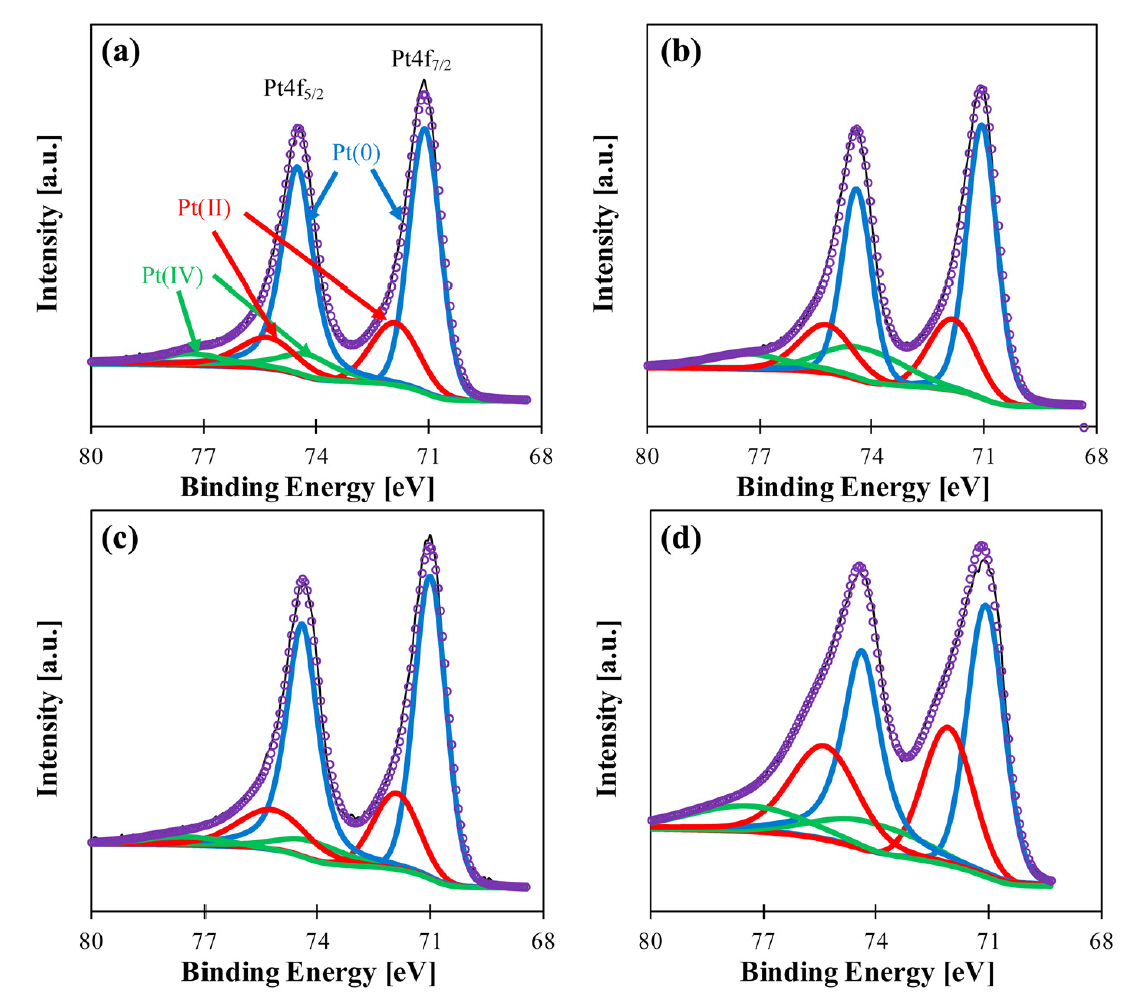
Fig.┬Ā3.Schematic illustration of the synthetic process of the ordered intermetallic PtCo/NGC for ORR: (a) Co encapsulated with CN layers on GC (Co@CN/GC); (b) Pt nanoparticles deposited on Co@CN/GC by modified polyol method; (c) Co diffused to the Pt lattice to form the ordered intermetallic alloy; and (d) the formation of ordered intermetallic PtCo on NGC. Reproduced from Ref. 44 with permission from The Royal Society of Chemistry. 
Fig.┬Ā4.(a, c) HAADF-STEM images and (b, d) corresponding EDS elemental mapping images of Pt/Co@CN/GC and PtCo/NGC, respectively. (e) HAADF-STEM image of PtCo nanoparticle for PtCo/NGC. (f) XEDS line-scan of PtCo/NGC catalyst (Pt: pink and Co: green). Reproduced from Ref. 44 with permission from The Royal Society of Chemistry. 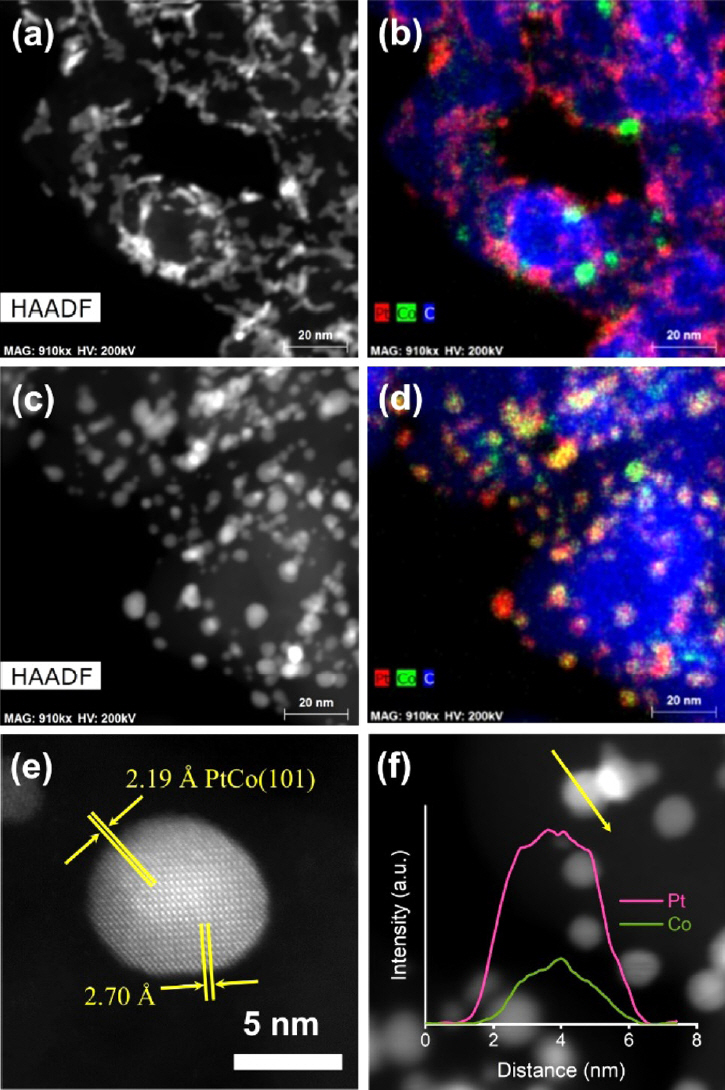
Fig.┬Ā5.(a) H2/air polarization curves of PtCo/CCCS-800 polarization curves before and after AST (b) ECSA losses of PtCo/CCCS-800 and commercial Pt/C catalysts as a function of cycle number (c) Mass activities before and after AST for the PtCo/CCCS-800 and commercial Pt/C catalysts. AST was conducted by 30,000 potential cycles between 0.6 and 1.0 V. Reproduced with permission from Ref. 17. Copyright (2017) American Chemical Society. 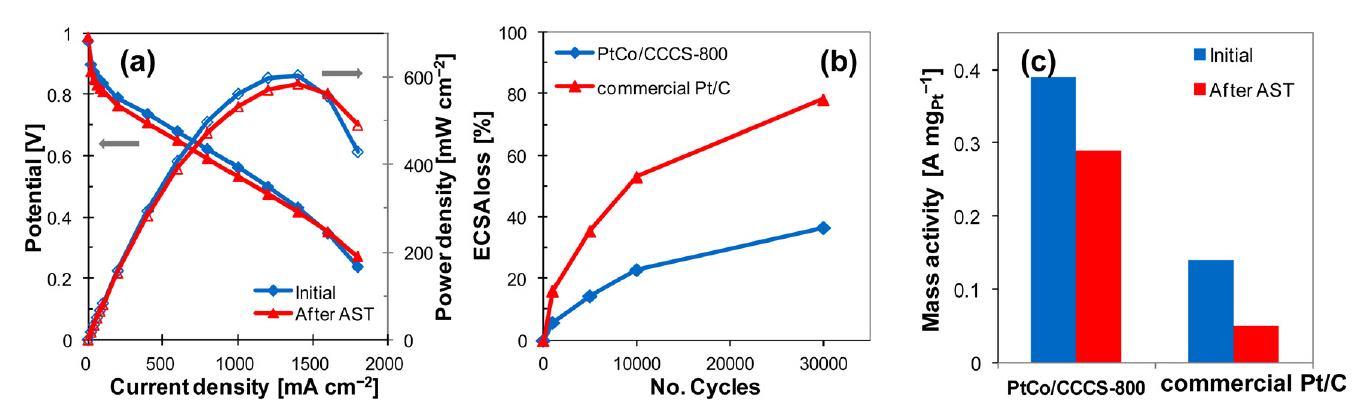
Fig.┬Ā6.TEM images of (a) commercial Pt/C, (b) PtFe_ASP, (c) PtFe 700_Ar, (d) PtFe 700_H2, (e) PtFe 900_Ar, and (f) PtFe 900_H2. The insets show the extended images for PtFe nanoparticles coated with carbon shells. Reproduced from Ref. 53 with permission. 
Fig.┬Ā7.(a) Super-cell illustration, (b) fcc lattice parameters of Pd1ŌłÆxCux for different compositions x, and the relationship between surface binding strength and position of the d-band center for ORR intermediates: (c) OH species on the top sites and (d) oxygen atoms on fcc and hcp hollow sites. Reproduced from Ref. 67 with permission. 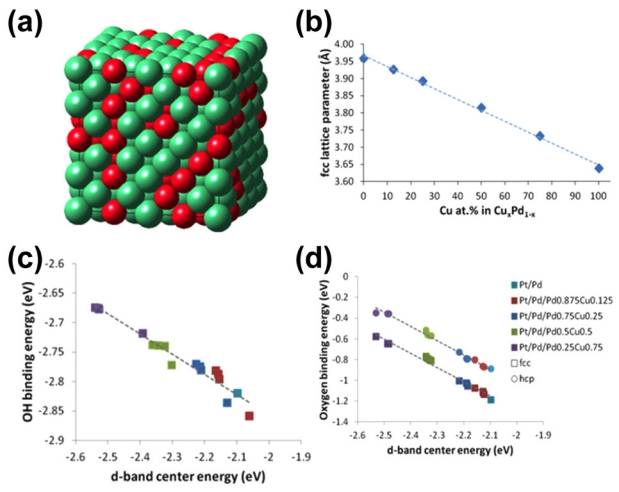
Table┬Ā1.Pt-Ni ņ┤ēļ¦żņØś ORR ĒÖ£ņä▒ ļ╣äĻĄÉ
Table┬Ā2.Pt-Co ņ┤ēļ¦żņØś ORR ĒÖ£ņä▒ ļ╣äĻĄÉ
Table┬Ā3.Pt-Fe ņ┤ēļ¦żņØś ORR ĒÖ£ņä▒ ļ╣äĻĄÉ
Table┬Ā4.Pt-M ņ┤ēļ¦żņØś ORR ĒÖ£ņä▒ ļ╣äĻĄÉ
REFERENCES1. W. Gong, Z. Jiang, R. Wu, Y. Liu, L. Huang, N. Hu, P. Tsiakaras, and P. K. Shen, Appl. Catal. B Environ. 246, 277 (2019).
2. P. R. Kumar, P. L. Suryawanshi, S. P. Gumfekar, B. A. Bhanvase, and S. Sonawane, Surfaces and Interfaces. 12, 116 (2018).
5. A. Bonakdarpour, R. L├Čbel, R. T. Atanasoski, G. D. Vernstrom, A. K. Schmoeckel, M. K. Debe, and J. R. Dahn, J. Electrochem. Soc. 153, A1835 (2006).
8. V. Tripkovi─ć, E. Sk├║lason, S. Siahrostami, J. K. N├Ėrskov, and J. Rossmeisl, Electrochim. Acta. 55, 7975 (2010).
9. K. Wikander, H. Ekstr├Čm, A. E. C. Palmqvist, and G. Lindbergh, Electrochim. Acta. 52, 6848 (2007).
11. K. J. J. Mayrhofer, J. C. Meier, S. J. Ashton, G. K. H. Wiberg, F. Kraus, M. Hanzlik, and M. Arenz, Electrochem. Commun. 10, 1144 (2008).
12. T. Y. Jeon, S. J. Yoo, Y. H. Cho, S. H. Kang, and Y. E. Sung, Electrochem. Commun. 12, 1796 (2010).
15. Y. Liu, Z. Li, S. Xu, Y. Xie, Y. Ye, X. Zou, and S. Lin, J. Colloid Interface Sci. 554, 640 (2019).
16. M. Escudero-Escribano, P. Malacrida, H. M. Hansen, U. Vej-Hansen, A. Velazquez-Palenzuela, V. Tripkovic, J. Schi├Ėtz, J. Rossmeisl, I. E. L. Stephens, and I. Chorkendorff, Science 80. 352, 73 (2016).
18. W. kyo Suh, P. Ganesan, B. Son, H. Kim, and S. Shanmugam, Int. J. Hydrogen Energy. 41, 12983 (2016).
25. Y. Chen, J. Wang, X. Meng, Y. Zhong, R. Li, X. Sun, S. Ye, and S. Knights, J. Power Sources. 238, 144 (2013).
26. C. W. B. Bezerra, L. Zhang, H. Liu, K. Lee, A. L. B. Marques, E. P. Marques, H. Wang, and J. Zhang, J. Power Sources. 173, 891 (2007).
28. K. W. Park, J. H. Choi, B. K. Kwon, S. A. Lee, Y. E. Sung, H. Y. Ha, S. A. Hong, H. Kim, and A. Wieckowski, J. Phys. Chem. B. 106, 1869 (2002).
32. C. A. Campos-Rold├Īn, L. Calvillo, G. Granozzi, and N. Alonso-Vante, J. Electroanal. Chem. 857, 113449 (2020).
33. G. Rosado, Y. Verde, A. M. Valenzuela-Mu├▒iz, R. Barbosa, M. Miki Yoshida, and B. Escobar, Int. J. Hydrogen Energy. 41, 23260 (2016).
35. I. Khalakhan, L. Supik, M. Vorokhta, Y. Yakovlev, M. Dopita, D. J. S. Sandbeck, S. Cherevko, K. Veltrusk├Ī, and I. Matol├Łnov├Ī, Appl. Surf. Sci. 511, 145486 (2020).
36. V. R. Stamenkovic, B. S. Mun, M. Arenz, K. J. J. Mayrhofer, C. A. Lucas, G. Wang, P. N. Ross, and N. M. Markovic, Nat. Mater. 6, 241 (2007).
38. S. Beyhan, N. E. ┼×ahin, S. Pronier, J. M. L├®ger, and F. Kadirgan, Electrochim. Acta. 151, 565 (2015).
39. C. A. Cort├®s-Escobedo, R. D. G. Gonz├Īlez-Huerta, A. M. Bolar├Łn-Mir├│, F. S├Īnchez De Jes├║s, Q. Zhu, S. E. Canton, K. Suarez-Alcantara, and M. Tufi├▒o-Velazquez, Int. J. Hydrogen Energy. 39, 16722 (2014).
41. A. Schenk, C. Grimmer, M. Perchthaler, S. Weinberger, B. Pichler, C. Heinzl, C. Scheu, F. A. Mautner, B. Bitschnau, and V. Hacker, J. Power Sources. 266, 313 (2014).
43. B. Li, Z. Yan, Q. Xiao, J. Dai, D. Yang, C. Zhang, M. Cai, and J. Ma, J. Power Sources. 270, 201 (2014).
46. S. Hu, Z. Wang, H. Chen, S. Wang, X. Li, X. Zhang, and P. K. Shen, J. Electroanal. Chem. 870, 114194 (2020).
49. Y. H. Chung, D. Y. Chung, N. Jung, H. Y. Park, Y. E. Sung, and S. J. Yoo, Int. J. Hydrogen Energy. 39, 14751 (2014).
50. Y. Qin, L. Chao, J. J. He, Y. Liu, F. Chu, J. Cao, Y. Kong, and Y. Tao, J. Power Sources. 335, 31 (2016).
53. Y. Kim, A. A. Jeffery, J. Min, and N. Jung, Nanomaterials. 9, (2019).
54. L. S. R. Silva, F. E. L├│pez-Su├Īrez, M. Perez-Cadenas, S. F. Santos, L. P. da Costa, K. I. B. Eguiluz, and G. R. Salazar-Banda, Appl. Catal. B Environ. 198, 38 (2016).
56. S. Y. Yan, C. W. Liu, T. H. Huang, Y. Z. Guo, S. W. Lee, J. H. Wang, and K. W. Wang, Int. J. Hydrogen Energy. 43, 14427 (2018).
57. B. Geboes, I. Mintsouli, B. Wouters, J. Georgieva, A. Kakaroglou, S. Sotiropoulos, E. Valova, S. Armyanov, A. Hubin, and T. Breugelmans, Appl. Catal. B Environ. 150, 249 (2014).
58. J. Garcia-Cardona, I. Sir├®s, F. Alcaide, E. Brillas, F. Centellas, and P. L. Cabot, Int. J. Hydrogen Energy. 45, 20582 (2020).
60. M. S. M. Yusof, A. A. Jalil, A. Ahmad, S. Triwahyono, M. H. D. Othman, T. A. T. Abdullah, M. L. Firmansyah, H. D. Setiabudi, A. Johari, and W. Nabgan, Int. J. Hydrogen Energy. 44, 20760 (2019).
61. B. Ruiz-Camacho, O. Mart├Łnez ├ülvarez, H. H. Rodr├ŁguezSantoyo, P. A. L├│pez-Per├®z, and R. Fuentes-Ram├Łrez, Electrochem. Commun. 61, 5 (2015).
64. M. A. Matin, J. Lee, G. W. Kim, H. U. Park, B. J. Cha, S. Shastri, G. Kim, Y. D. Kim, Y. U. Kwon, and V. Petkov, Appl. Catal. B Environ. 267, (2020).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||