1. ņä£ ļĪĀ
ĒīöļØ╝ļōÉņØĆ ĻĖł, ņØĆ, ļ░▒ĻĖłĻ│╝ ļŹöļČłņ¢┤ 4ļīĆ ĻĘĆĻĖłņåŹņ£╝ļĪ£ ļČłļ”¼ļ®░ ĒīöļØ╝ļōÉņØś Ļ░ĆĻ▓®ņØĆ ĻĖłĻ│╝ ļ╣äņŖĘĒĢśĻ▒░ļéś ņśżĒ׳ļĀż ļ╣äņŗ╝ ņłśņżĆņØ┤ļŗż[1]. ĒīöļØ╝ļōÉņØĆ ņÜ░ņłśĒĢ£ ņ┤ēļ¦żļŖźļĀźņ£╝ļĪ£ ņØĖĒĢ┤ ņŻ╝ļĪ£ ļČłĒżĒÖö ĒāäĒÖö ņłśņåīņØś ņłśņåīĒÖö ļ░śņØæ ļ░Å ņ×ÉļÅÖņ░© ļ░░ĻĖ░Ļ░ĆņŖż ņ┤ēļ¦żļĪ£ ņé¼ņÜ®ļÉ£ļŗż[2]. ņ×ÉļÅÖņ░© ļ░░ĻĖ░Ļ░ĆņŖżņŚÉ ļīĆĒĢ£ ĒÖśĻ▓ĮĻĘ£ņĀ£Ļ░Ć Ļ░ĢĒÖöļÉ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉņØś ņłśņÜöĻ░Ć ĻĖēņ”ØĒ¢łņ£╝ļéś Ļ│ĄĻĖēņØ┤ ņłśņÜöņŚÉ ļ»Ėņ╣śņ¦Ć ļ¬╗ĒĢ┤ ņĄ£ĻĘ╝ 10ļģäĻ░ä Ļ░ĆĻ▓®ņØ┤ 4~5ļ░░ Ļ░ĆĻ╣īņØ┤ ņāüņŖ╣Ē¢łļŗż [3]. ĒīöļØ╝ļōÉņØĆ ņ¦ĆĻ░üņŚÉ 0.001 ppm ļåŹļÅäļĪ£ ļ¦żņÜ░ ĒؼĻĘĆĒĢśĻ▓ī ņĪ┤ņ×¼ĒĢśļ»ĆļĪ£ ĒīöļØ╝ļōÉņØä ņĢłņĀĢņĀüņ£╝ļĪ£ Ļ│ĄĻĖēĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö 2ņ░©ņ×ÉņøÉņŚÉ ĒĢ©ņ£ĀļÉ£ ĒīöļØ╝ļōÉņØä ĒÜīņłśĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ĒÅÉņ┤ēļ¦żņŚÉņä£ ĒīöļØ╝ļōÉņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ļŖö ĻŠĖņżĆĒ׳ ņłśĒ¢ēļÉśĻ│Ā ņ׳ņ£╝ļéś, ļÅäĻĖłĒÅÉņĢĪĻ│╝ Ļ░ÖņØ┤ ĒīöļØ╝ļōÉņØ┤ ļ»Ėļ¤ē ĒĢ©ņ£ĀļÉ£ 2ņ░© ņ×ÉņøÉņØś Ļ▓ĮņÜ░ ĒÜīņłśņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņĢäņ¦ü ļČĆņĪ▒ĒĢ£ ņŗżņĀĢņØ┤ļŗż[4-6]. ņØ╝ļ░śņĀüņ£╝ļĪ£ ļÅäĻĖłĒÅÉņĢĪņŚÉņä£ ņ£ĀĻ░ĆĻĖłņåŹņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ļ░®ļ▓ĢņŚÉļŖö ĒÖöĒĢÖ ņ╣©ņĀä, ņØ┤ņś©ĻĄÉĒÖś, ņĀäĻĖ░Ēł¼ņäØ ļō▒ņØ┤ ņ׳ļŗż. ĒÖöĒĢÖ ņ╣©ņĀäņØś Ļ▓ĮņÜ░ ĻĖ┤ ņ╣©ņĀäņŗ£Ļ░äĻ│╝ ļČĆĒö╝Ļ░Ć Ēü░ ņŖ¼ļ¤¼ņ¦Ćļź╝ ņāØņä▒ĒĢ£ļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳Ļ│Ā, ņØ┤ņś©ĻĄÉĒÖś ļ░Å ņĀäĻĖ░Ēł¼ņäØņØĆ ļ╣äņŗ╝ Ļ│ĄņĀĢļ╣äņÜ® ļ░Å ņןļ╣äļĪ£ ņØĖĒĢ┤ ļ»Ėļ¤ēņØś ĻĖłņåŹņØä ņ▓śļ”¼ĒĢśļŖöļŹ░ ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖļŗż[7]. ļö░ļØ╝ņä£ ļÅäĻĖłĒÅÉņĢĪĻ│╝ Ļ░ÖņØ┤ ļ¬®ņĀü ĻĖłņåŹņä▒ļČäņØ┤ ļ»Ėļ¤ēņØĖ Ļ▓ĮņÜ░ņŚÉļŖö ļ¬®ņĀüĻĖłņåŹņØś ĒÜ©ņ£©ņĀüņØĖ ļåŹņČĢĻ│╝ņĀĢņØ┤ ĒĢäņÜöĒĢśļŗż. ĒīöļØ╝ļōÉņØ┤ ĒĢ©ņ£ĀļÉ£ ļÅäĻĖłĒÅÉņĢĪņŚÉ ņ▓Ā, ņĢīļŻ©ļ»ĖļŖä ļśÉļŖö ņĢäņŚ░ĻĖłņåŹļČäļ¦ÉņØä ņ▓©Ļ░ĆĒĢśļ®┤ ļæÉ ĻĖłņåŹņØś ņØ┤ņś©ĒÖöĻ▓ĮĒ¢ź ņ░©ņØ┤ņŚÉ ņØśĒĢ┤ ĒīöļØ╝ļōÉņØ┤ņś©ņØ┤ ĻĖłņåŹņ£╝ļĪ£ ĒÖśņøÉļÉ£ļŗż [8-10]. ĻĘĖļ¤¼ļéś ņÜ®ļ¦żņČöņČ£Ļ│╝ Ļ░ÖņØĆ ĒøäņåŹĻ│ĄņĀĢņŚÉņä£ ņ▓ĀņØĆ ļ░▒ĻĖłņĪ▒ņØä ņäĀĒāØņĀüņ£╝ļĪ£ ņČöņČ£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņ¦ä Cyanex 301ņŚÉ ĒĢ©Ļ╗ś ņČöņČ£ļÉĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ®░, ļśÉĒĢ£ ĒāłĻ▒░Ļ░Ć ņ¢┤ļĀżņÜ░ļ»ĆļĪ£ ĻĖłņåŹņØś ļČäļ”¼ļź╝ ņ£äĒĢ┤ ņĢäņŚ░ĻĖłņåŹņØä ņ╣śĒÖśņĀ£ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØ┤ ņ£Āļ”¼ĒĢśļŗż [11-13]. ĻĘĖļ”¼Ļ│Ā ĒīöļØ╝ļōÉņØ┤ņś©ņØĆ ņĢäņŚ░Ļ│╝ ļ╣äĻĄÉĒĢ┤ ļåÆņØĆ Ēæ£ņżĆĒÖśņøÉņĀäņ£äļź╝ Ļ░Ćņ¦Ćļ»ĆļĪ£ ĒīöļØ╝ļōÉ ĻĖłņåŹņØä ņ╣©ņČ£ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ļ░śļō£ņŗ£ ņé░ĒÖöņĀ£Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ļÅäĻĖłĒÅÉņĢĪņØä ņĢäņŚ░ņ£╝ļĪ£ ņ╣śĒÖśĒĢ£ ĒīöļØ╝ļōÉņØś ĒÜīņłśļź╝ ņ£äĒĢ£ ĻĖ░ņ┤ł ņŚ░ĻĄ¼ļĪ£ ĒīöļØ╝ļōÉ ļŗ©ņØ╝ ĻĖłņåŹ ļ░Å ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś ņ╣©ņČ£Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. ņØ┤ļ¤¼ĒĢ£ ļ¬®ņĀüņØä ņ£äĒĢ┤ ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņÜ®ņĢĪņØä ņ╣©ņČ£ņĢĪņ£╝ļĪ£ ņé¼ņÜ®Ē¢łĻ│Ā, ņé░ĒÖöņĀ£ļĪ£ H2O2, NaClO3, NaClOļź╝ ņ▓©Ļ░ĆĒ¢łļŗż. ņ╣©ņČ£ņĢĪĻ│╝ ņé░ĒÖöņĀ£ņØś ņóģļźśņÖĆ ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£Ēéżļ®░ ļ░śņØæņś©ļÅä, ļ░śņØæņŗ£Ļ░ä ļ░Å Ļ┤æņĢĪļåŹļÅäņŚÉ ļö░ļźĖ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. ļśÉĒĢ£ ĒīöļØ╝ļōÉ ļŗ©ņØ╝ ĻĖłņåŹņØś ņ╣©ņČ£ņŚÉņä£ ņ¢╗ņØĆ ņĄ£ņĀü ņ╣©ņČ£ņĪ░Ļ▒┤ņŚÉņä£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ĻĖłņåŹņØś Ēś╝ĒĢ®ļ¼╝ņØä ļ¬©ļæÉ ņ╣©ņČ£ņŗ£Ēé¼ ņłś ņ׳ļŖö ņĪ░Ļ▒┤ņØä ĻĄ¼Ē¢łļŗż. ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ļŖö H2O2, NaClO3, NaClOĻ░Ć ĒīöļØ╝ļōÉ ņ╣©ņČ£ņŚÉ ĒÜ©Ļ│╝ņĀüņØĖ ļ░śļ®┤, ĒÖ®ņé░ņŚÉņä£ļŖö NaClOļ¦īņØ┤ ņ╣©ņČ£ņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż. ļśÉĒĢ£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ ĻĖłņåŹņØś Ēś╝ĒĢ®ļ¼╝ņŚÉņä£ ĒīöļØ╝ļōÉņØä 99% ņØ┤ņāü ņ╣©ņČ£ĒĢĀ ņłś ņ׳ļŖö ņĪ░Ļ▒┤ņØä ĻĄ¼Ē¢łļŗż.
2. ņŗżĒŚś ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
2.1 ņŗżĒŚśņ×¼ļŻī
ņ╣©ņČ£ņŗżĒŚśņŚÉļŖö ĒīöļØ╝ļōÉ(size -60 mesh, Alfa Aesar, 99.9%) ļ░Å ņĢäņŚ░(size 100~200 mesh, Daejung Chemical. Co., > 99.0%) ĻĖłņåŹļČäļ¦ÉņØä ņé¼ņÜ®Ē¢łļŗż. ņ╣©ņČ£ņÜ®ņĢĪņ£╝ļĪ£ ņŚ╝ņé░(Daejung Co., 35%)Ļ│╝ ĒÖ®ņé░ņÜ®ņĢĪ(Daejung Co., 98%)ņØä ņé¼ņÜ®Ē¢łĻ│Ā, 2ņ░© ņ”ØļźśņłśļĪ£ ņ╣©ņČ£ņÜ®ņĢĪņØś ļåŹļÅäļź╝ ņĪ░ņĀłĒ¢łļŗż. ņé░ĒÖöņĀ£ļĪ£ Ļ│╝ņé░ĒÖöņłśņåī(H2O2, Daejung Chemical & Metals Co., > 30%), ņŚ╝ņåīņé░ļéśĒŖĖļź©(NaClO3, Chemical. Co., > 98%), ņ░©ņĢäņŚ╝ņåīņé░ļéśĒŖĖļź©(NaClO, Sigma-Aldrich with available chlorine 10-15%)ņØä ņé¼ņÜ®Ē¢łņ£╝ļ®░, ļ¬©ļōĀ ņŗ£ņĢĮņØĆ ļČäņäØĻĖēņ£╝ļĪ£ ļ│äļÅäļĪ£ ņĀĢņĀ£ĒĢśņ¦Ć ņĢŖĻ│Ā ņé¼ņÜ®Ē¢łļŗż.
2.2 ņŗżĒŚśļ░®ļ▓Ģ
ņ╣©ņČ£ņŗżĒŚśņØĆ Ļ░ĆņŚ┤ĻĄÉļ░śĻĖ░(WiseStir MSH-20D, Daihan Scientific Co., Korea) ņ£äņŚÉ ņ╣©ņČ£ņÜ®ņĢĪņØ┤ ļŗ┤ĻĖ┤ 250 mL ļé┤ņÜ®ņĀüņØś 3ĻĄ¼ ļ╣äņØ┤ņ╗żĒśĢ ņ¦äĒāĢ ļ░śņØæņĪ░ļź╝ ņś¼ļĀżļåōĻ│Ā, ņś©ļÅäļź╝ ņĪ░ņĀłĒĢ£ ļŗżņØī 300 rpm ņåŹļÅäļĪ£ ĻĄÉļ░śĒĢ┤ ņłśĒ¢ēĒ¢łļŗż. Ļ░ĆņŚ┤ĻĄÉļ░śĻĖ░ņŚÉņä£ ņ╣©ņČ£ņÜ®ņĢĪņØ┤ ļ░śņØæņś©ļÅäņŚÉ ļÅäļŗ¼ĒĢśļ®┤ ĻĖłņåŹ ļČäļ¦É, ņé░ĒÖöņĀ£ņØś ņł£ņä£ļĪ£ ņ▓©Ļ░ĆĒĢ┤ ļ░śņØæņŗ£Ļ░äļÅÖņĢł ņ╣©ņČ£Ē¢łļŗż. ņé░ĒÖöņĀ£ņØś ļåŹļÅäļŖö ņĢĪņ▓┤ņØĖ Ļ▓ĮņÜ░ %ļĪ£, Ļ│Āņ▓┤ ņŚ╝ņåīņé░ļéśĒŖĖļź©ņØĆ g/LļĪ£ ļéśĒāĆļāłļŗż. ņ╣©ņČ£ņØ┤ ļüØļé£ ļÆż ņ╣©ņČ£ņÜ®ņĢĪņØä ņŚ¼Ļ│╝ņ¦ĆļĪ£ ņŚ¼Ļ│╝ĒĢ┤ ņ×öņé¼ņÖĆ ļČäļ”¼Ē¢łļŗż. ņ╣©ņČ£ņÜ®ņĢĪņŚÉ ļģ╣ņĢäņ׳ļŖö ĻĖłņåŹņØś ļåŹļÅäļŖö ICP-OES (Arcos, Spectro, Germany)ļĪ£ ņĖĪņĀĢĒ¢łņ£╝ļ®░, Ļ░ü ĻĖłņåŹņØś ņ╣©ņČ£ļźĀņØĆ ļŗżņØī ņŗØņ£╝ļĪ£ ĻĄ¼Ē¢łļŗż.
ņāüĻĖ░ ņŗØņŚÉņä£ miĻ│╝ meļŖö Ļ░üĻ░ü ĻĖłņåŹņØś ņ┤łĻĖ░ ņ¦łļ¤ēĻ│╝ ņ╣©ņČ£ ņÜ®ņĢĪņŚÉ ņÜ®ĒĢ┤ļÉ£ ĻĖłņåŹņØś ņ¦łļ¤ēņØä ļéśĒāĆļéĖļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1 ņé░ ļåŹļÅäņØś ņśüĒ¢ź
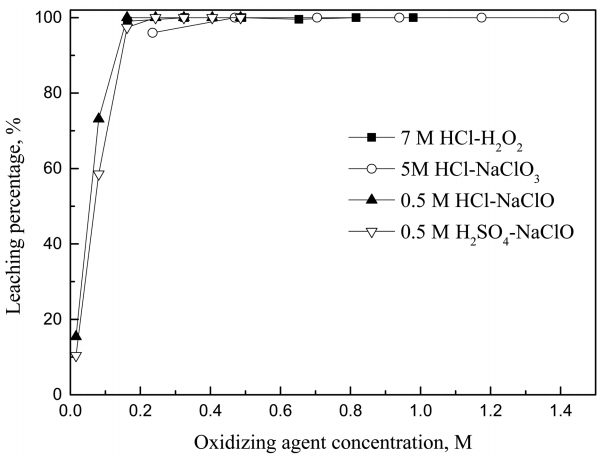
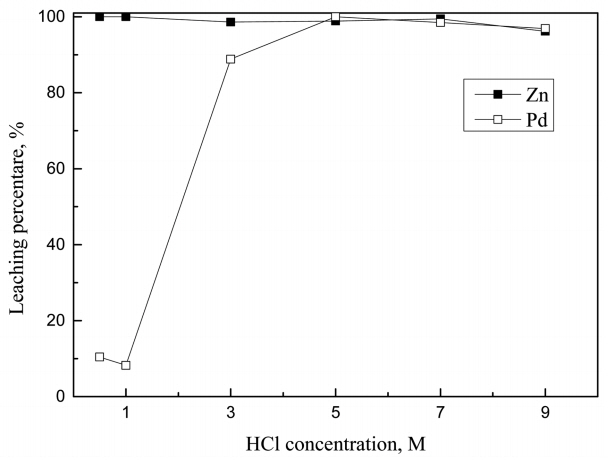
ĒīöļØ╝ļōÉ ņ╣©ņČ£ņØä ņ£äĒĢ┤ ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ņÜ®ņĢĪņŚÉ 3Ļ░Ćņ¦Ć ņé░ĒÖöņĀ£(H2O2, NaClO, NaClO3)ļź╝ ņ▓©Ļ░ĆĒĢ┤ ņ╣©ņČ£ļźĀņØä ļ╣äĻĄÉĒ¢łļŗż. ļ©╝ņĀĆ ņé░ļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ ņé░ļåŹļÅäļź╝ 0.5ņŚÉņä£ 9MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░Ļ│Ā, ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 1ņŚÉ ļéśĒāĆļāłļŗż. ļ│Ė ņŗżĒŚśņŚÉņä£ Ļ┤æņĢĪļåŹļÅäļŖö 1 g/LļĪ£ Ļ│ĀņĀĢĒ¢łņ£╝ļ®░, H2O2ņÖĆ NaClOņØś ļåŹļÅäļŖö 3%ļĪ£, NaClO3ļŖö 3 g/LļĪ£ Ļ│ĀņĀĢĒ¢łļŗż. 7 M ĒÖ®ņé░ņŚÉ ņé░ĒÖöņĀ£ļĪ£ 3 g/L NaClO3ļź╝ ņ▓©Ļ░ĆĒ¢łņØä ļĢī ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ 1.2%ļĪ£ ļ¦żņÜ░ ļé«ĻĖ░ ļĢīļ¼ĖņŚÉ ņČöĻ░ĆņŗżĒŚśņØä ņłśĒ¢ēĒĢśņ¦Ć ņĢŖņĢśĻ│Ā, ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņ¦Ć ņĢŖņĢśļŗż. NaClO3ņØä ņé░ĒÖöņĀ£ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ĒīöļØ╝ļōÉņØä ņ╣©ņČ£ņŗ£ĒéżļŖö Ļ▓ĮņÜ░ņŚÉļŖö ĒīöļØ╝ļōÉņØś ņŚ╝ĒÖöņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ╝ņåīņØ┤ņś©ņØ┤ ĒĢäņÜöĒĢśļ»ĆļĪ£ ĒÖ®ņé░ņŚÉ NaCl ļō▒ņØä ņ▓©Ļ░ĆĒĢ┤ ņŚ╝ņåī ņØ┤ņś©ņØä Ļ│ĄĻĖēĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż [14].
25 ┬░CņŚÉņä£ ĒīöļØ╝ļōÉ, ņĢäņŚ░ ļ░Å ņé░ĒÖöņĀ£ņØś Ēæ£ņżĆĒÖśņøÉņĀäņ£äļź╝ Ēæ£ 1ņŚÉ ļéśĒāĆļāłļŗż [15]. Ēæ£ 1ņŚÉ ņØśĒĢśļ®┤ Pd(II)ņØś Ēæ£ņżĆĒÖśņøÉņĀäņ£äļŖö 0.951 VņØ┤ļéś PdCl42-ņØś Ēæ£ņżĆĒÖśņøÉņĀäņ£äļŖö 0.591 VņØ┤ļŗż[16]. ļö░ļØ╝ņä£ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ Pd(II)Ļ░Ć ņŚ╝ņåīņØ┤ņś©Ļ│╝ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢśļ®┤ Pd(II)ļ│┤ļŗż ļŹö ņēĮĻ▓ī ĒÖśņøÉļÉĀ ņłś ņ׳ļŗż. HCl-3% H2O2ņÜ®ņĢĪņŚÉņä£ ņé░ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØĆ ņÜ®ņĢĪ ļé┤ ņŚ╝ņåīņØ┤ņś© ļåŹļÅäņØś ņ”ØĻ░ĆņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż. ņŚ╝ņé░ņŚÉņä£ H2O2ļŖö HClOņÖĆ Cl2ņØä ĒśĢņä▒ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļ░śņØæņŗØņØä ņŗØ (2)ņÖĆ (3)ņŚÉ ļéśĒāĆļāłļŗż [17].
ņāüĻĖ░ ņŗØņ▓śļ¤╝ ņŚ╝ņé░ņŚÉņä£ H2O2ļŖö HClOņÖĆ Cl2ņÖĆ Ļ░ÖņØĆ Ļ░ĢļĀźĒĢ£ ņé░ĒÖöņĀ£ļź╝ ĒśĢņä▒ĒĢĀ ņłś ņ׳Ļ│Ā, ĒīöļØ╝ļōÉņØ┤ ņŚ╝ĒÖöņ░®ļ¼╝ ĒśĢĒā£ļĪ£ ņÜ®ĒĢ┤ļÉśļ»ĆļĪ£ ņ╣©ņČ£ļźĀņØ┤ ļåÆņĢśļŗż. ĻĘĖļ¤¼ļéś ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ņé░ĒÖöņĀ£ļĪ£ H2O2ļź╝ ņ▓©Ļ░ĆĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ ĒīöļØ╝ļōÉņØĆ Ļ▒░ņØś ņ╣©ņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ņŚ╝ņåīņØ┤ņś©ņØ┤ ņĪ┤ņ×¼ĒĢśņ¦Ć ņĢŖļŖö ņł£ņłśĒĢ£ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļŖö H2O2ņŚÉ ņØśĒĢ┤ HClO ļ░Å Cl2 Ļ░ÖņØĆ Ļ░ĢļĀźĒĢ£ ņé░ĒÖöņĀ£ļź╝ ĒśĢņä▒ĒĢśĻĖ░ ņ¢┤ļĀżņÜĖ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŚ╝ĒÖöĒīöļØ╝ļōÉņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ļö░ļØ╝ņä£ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ H2O2ļź╝ ņ▓©Ļ░ĆĒĢ£ ņĪ░Ļ▒┤ņŚÉ ļīĆĒĢ┤ ņČöĻ░ĆņŗżĒŚśņØä ņłśĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż.
ļŗżņØīņ£╝ļĪ£ NaClO3 ņŚŁņŗ£ H2O2ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņŚ╝ņé░ņŚÉņä£ Cl2ļź╝ ĒśĢņä▒ĒĢĀ ņłś ņ׳ņ¢┤ ņØ┤ļź╝ ĒåĄĒĢ┤ ņŚ╝ņé░ņŚÉņä£ ĒīöļØ╝ļōÉņØ┤ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ╣©ņČ£ļÉśņŚłņ£╝ļéś, ņŚ╝ņåīņØ┤ņś©ņØ┤ ņĪ┤ņ×¼ĒĢśņ¦Ć ņĢŖļŖö ĒÖ®ņé░ņŚÉņä£ļŖö ņ╣©ņČ£ļźĀņØ┤ ļé«ņĢśļŗż. ņŗØ (4)ņŚÉ NaClO3ņÖĆ ņŚ╝ņé░ņØś ļ░śņØæņŗØņØä ļéśĒāĆļāłļŗż.
ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ NaClOļź╝ ņ▓©Ļ░ĆĒĢ£ 0.5 MņØś ļé«ņØĆ ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉņØ┤ 99%ņØ┤ņāü ņ╣©ņČ£ļÉÉņ£╝ļ®░, ņØ┤ļĢī ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņØś ļåŹļÅäļŖö ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśļŗż. ņŗØ (5)ņÖĆ (6)ņŚÉ ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ NaClOņØś ļ░śņØæņØä ļéśĒāĆļāłļŗż.
ņ£ä ļ░śņØæņŗØņ▓śļ¤╝ NaClOļŖö ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ņłśņåīņØ┤ņś©Ļ│╝ ļ░śņØæĒĢ┤ HClOļź╝ ĒśĢņä▒ĒĢĀ ņłś ņ׳ļŗż. ņŗżņĀ£ ĒÖ®ņé░ļåŹļÅäĻ░Ć ļåÆņØĆ Ļ▓ĮņÜ░ ĒÖ®ņé░ņØś 1ņ░© ĒĢ┤ļ”¼ļ¦ī ņ£ĀĒÜ©ĒĢśļ»ĆļĪ£ NaClOņÖĆ ĒÖ®ņé░ņØ┤ ļŗ╣ļ¤ēļ╣ä 1:1ļĪ£ ļ░śņØæĒĢ£ļŗż.
ļ│Ė ļģ╝ļ¼ĖņØś ņŗżĒŚśņĪ░Ļ▒┤ņŚÉņä£ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņŗ£ ņé░ĒÖöņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ ļ¬©ļōĀ ņ╣©ņČ£ņÜ®ņĢĪņŚÉņä£ ņÜ®ņĢĪņØ┤ ļČēĻ▓ī ļ│ĆĒĢśļ»ĆļĪ£ PdCl42-Ļ░Ć ņĪ┤ņ×¼ĒĢśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż [18]. Ēæ£ 1ņØä ļ│┤ļ®┤ PdCl62-ņØś ĒÖśņøÉ ņĀäņ£äļŖö 1.288 VņØ┤Ļ│Ā, Cl2 ļ░Å HClOņØś ĒÖśņøÉņĀäņ£äĻ░Ć ņØ┤ļ│┤ļŗż Ēü¼ļ»ĆļĪ£ ņĀäĻĖ░ĒÖöĒĢÖņĀüņØĖ Ļ┤ĆņĀÉņŚÉņä£ Ļ░ĢļĀźĒĢ£ ņé░ĒÖöņĀ£ņØś ņĪ┤ņ×¼ĒĢśņŚÉ PdCl62-Ļ░Ć ĒśĢņä▒ļÉĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś PdCl62-ļŖö PdCl42-ņÖĆ ļ╣äĻĄÉĒĢ┤ ļČłņĢłņĀĢĒĢśļ»ĆļĪ£ ņ╣©ņČ£ņÜ®ņĢĪņŚÉņä£ PdCl42-Ļ░Ć ņŻ╝ĒÖöĒĢÖņóģņØ╝ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż [19,20]. ņé░ĒÖöņĀ£ ļåŹļÅäļź╝ Ļ│ĀņĀĢĒ¢łņØä ļĢī ĒīöļØ╝ļōÉ ņ╣©ņČ£ņØä ņ£äĒĢ£ ņĄ£ņĀüņØś ņŚ╝ņé░ ļåŹļÅäļŖö H2O2, NaClO3 ļ░Å NaClO ņ▓©Ļ░Ćņŗ£ Ļ░üĻ░ü 7, 3, 0.5 M ņØ┤ņŚłĻ│Ā, ņØ┤ļĢī ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØĆ 99% ņØ┤ņāüņØ┤ņŚłļŗż.
3.2 ņé░ĒÖöņĀ£ ļåŹļÅäņØś ņśüĒ¢ź
Ļ░üĻ░üņØś ņ╣©ņČ£ņÜ®ņĢĪņŚÉ ļīĆĒĢ┤ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņØä ņ£äĒĢ£ ņĄ£ņĀüņØś ņé░ ļåŹļÅäņŚÉņä£ ņé░ĒÖöņĀ£ ļåŹļÅäņØś ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ ņé░ĒÖöņĀ£ ļåŹļÅäļź╝ 0.01ņŚÉņä£ 3%(Ļ│Āņ▓┤ņØĖ Ļ▓ĮņÜ░ g/L)Ļ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░ļŗż. ņØ┤ļĢī ņé░ ļåŹļÅäļŖö 3.1ņĀłņŚÉņä£ ņ¢╗ņØĆ ņĄ£ņĀüļåŹļÅäļĪ£ Ļ│ĀņĀĢĒ¢łĻ│Ā, ņé░ĒÖöņĀ£ ļåŹļÅäļź╝ ļ¬░ļåŹļÅä(M)ļĪ£ ļ│ĆĒÖśĒĢ┤ ĻĘĖļ”╝ 2ņŚÉ ļéśĒāĆļāłļŗż. ļśÉĒĢ£ ņŗØ (7)-(9)ņŚÉ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ H2O2, NaClO3 ļ░Å NaClOņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļ░śņØæņØä ļéśĒāĆļāłļŗż.
ņŗżĒŚśĻ▓░Ļ│╝ H2O2ņÖĆ NaClOļŖö ņĢĮ 0.16 MņØś ļ╣äņŖĘĒĢ£ ļåŹļÅä ļ▓öņ£äņŚÉņä£ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ 97% ņØ┤ņāüņØĖ ļ░śļ®┤, NaClO3ļŖö 0.23 MņŚÉņä£ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ 96% ļ»Ėļ¦īņØ┤ņŚłļŗż. ĻĘĖļ¤¼ļéś ņĀäļ░śņĀüņ£╝ļĪ£ ļ╣äņŖĘĒĢ£ ņé░ĒÖöņĀ£ ļåŹļÅäņŚÉņä£ ņé░ĒÖöņĀ£ ņóģļźśņŚÉ ļö░ļźĖ ņ╣©ņČ£ļźĀ ņ░©ņØ┤ļŖö Ēü¼ņ¦Ć ņĢŖņĢśļŗż. Ļ░ü ņ╣©ņČ£ņÜ®ņĢĪņŚÉņä£ 99% ņØ┤ņāü ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØä ņ¢╗ĻĖ░ ņ£äĒĢ┤ņä£ 7 M ņŚ╝ņé░ņŚÉņä£ H2O2ļŖö 0.5%ļ¦ī ņ▓©Ļ░ĆĒĢ┤ļÅä ņČ®ļČäĒĢśĻ│Ā, NaClO3ļŖö 5 M ņŚ╝ņé░ņŚÉņä£ 1 g/LĻ░Ć ĒĢäņÜöĒ¢łļŗż. ļÅÖņØ╝ĒĢ£ ļåŹļÅäņØś ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ņŚÉņä£ NaClO ļåŹļÅäņŚÉ ļö░ļźĖ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØä Ēæ£ 2ņŚÉ ļéśĒāĆļāłļŗż. ļÅÖņØ╝ĒĢ£ NaClO ļåŹļÅäņŚÉ ļīĆĒĢ┤ ĒÖ®ņé░ņŚÉņä£ ļŹö ļ¦ÄņØĆ ņé░ĒÖöņĀ£Ļ░Ć ĒĢäņÜöĒĢ£ Ļ▓āņØĆ ņŚ╝ņé░ņŚÉņä£ļŖö ņŚ╝ņåīņØ┤ņś©ņØ┤ ĒīöļØ╝ļōÉņØ┤ņś©Ļ│╝ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢ┤ ļ╣äĻĄÉņĀü ņ╣©ņČ£ņØ┤ ņÜ®ņØ┤ĒĢśĻĖ░ ļĢīļ¼ĖņØĖ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
3.3 ļ░śņØæņś©ļÅä ļ░Å ļ░śņØæņŗ£Ļ░äņØś ņśüĒ¢ź
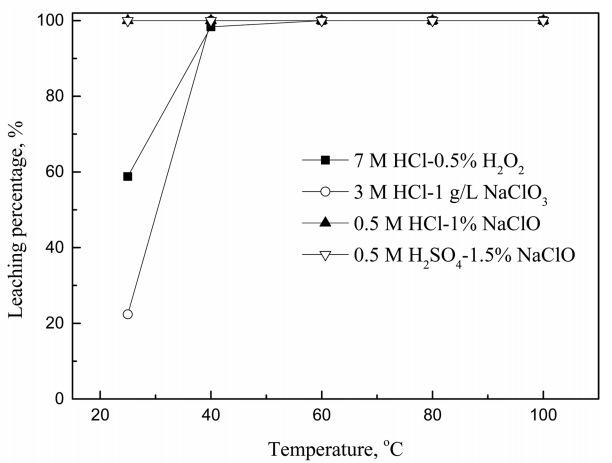
ļ░śņØæņś©ļÅä ļ░Å ļ░śņØæņŗ£Ļ░äņØ┤ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼Ē¢łļŗż. ļ░śņØæņś©ļÅäļŖö 25ņŚÉņä£ 100 ┬░CĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░Ļ│Ā, ļ░śņØæņŗ£Ļ░äņØĆ 10ņŚÉņä£ 60ļČäĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝£ ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż. ņś©ļÅäņŚÉ ļö░ļźĖ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀ ļ│ĆĒÖöļź╝ ĻĘĖļ”╝ 3ņŚÉ ļéśĒāĆļāłĻ│Ā, ņé░ĒÖöņĀ£ņŚÉ ļö░ļźĖ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļ░śņØæĻ│╝ ņ×Éņ£ĀņŚÉļäłņ¦Ćļ│ĆĒÖöļź╝ ņŗØ (10)-(13)ņŚÉ ļéśĒāĆļāłļŗż [21]. ņŚ╝ņé░ņŚÉņä£ H2O2ņÖĆ NaClO3ļŖö Ļ░üĻ░ü 60 ┬░CņÖĆ 40 ┬░CņŚÉņä£ ĒīöļØ╝ļōÉņØ┤ 99% ņØ┤ņāü ņ╣©ņČ£ļÉśņŚłņ£╝ļéś, NaClOņØś Ļ▓ĮņÜ░ ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ ļ¬©ļæÉņŚÉņä£ ņś©ļÅäņŚÉ ļ¼┤Ļ┤ĆĒĢśĻ▓ī ĒīöļØ╝ļōÉņØ┤ 99%ņØ┤ņāü ņ╣©ņČ£ļÉÉļŗż. ļö░ļØ╝ņä£ H2O2ņÖĆ NaClO3ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļ░śņØæņØĆ NaClOļ│┤ļŗż Ļ│Āņś©ņØ┤ ņÜöĻĄ¼ļÉśļ»ĆļĪ£ ĒÖ£ņä▒ĒÖöņŚÉļäłņ¦ĆĻ░Ć ļåÆļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż.
ļ░śņØæņŗ£Ļ░äņŚÉ ļö░ļźĖ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀ ļ│ĆĒÖöļź╝ ĻĘĖļ”╝ 4ņŚÉ ļéśĒāĆļāłļŗż. ņ┤ēļ¦żĻ░Ć ņŚåļŖö Ļ▓ĮņÜ░ H2O2ņØś ļČäĒĢ┤ļ░śņØæņØĆ ļ¦żņÜ░ ļŖÉļ”¼Ļ▓ī ņØ╝ņ¢┤ļéśļ»ĆļĪ£ 99% ņØ┤ņāü ĒīöļØ╝ļōÉņØä ņ╣©ņČ£ĒĢśĻĖ░Ļ╣īņ¦Ć ņĄ£ņåī 60ļČä ņØ┤ņāüņØ┤ ņåīņÜöļÉÉļŗż [22]. NaClO3ļŖö ļ░śņØæņŗ£Ļ░ä 10ļČäņŚÉņä£ļŖö ĒīöļØ╝ļōÉ(II)ņØś ņ╣©ņČ£ļźĀņØ┤ 13.5%ļĪ£ ļé«ņĢśņ£╝ļéś, ļ░śņØæņŗ£Ļ░äņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣©ņČ£ļźĀņØ┤ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢ┤ 30ļČä ņØ┤ĒøäņŚÉļŖö ĒīöļØ╝ļōÉņØ┤ ļīĆļČĆļČä ņ╣©ņČ£ļÉÉĻ│Ā, NaClOļŖö ņØ┤ļ│┤ļŗż ļ╣ĀļźĖ 20ļČäļ¦īņŚÉ ĒīöļØ╝ļōÉ ņ╣©ņČ£ļźĀņØ┤ 99%ņŚÉ ļÅäļŗ¼Ē¢łļŗż. NaClO3ņØś ļ░śņØæņŗ£Ļ░äņØ┤ NaClO ļ│┤ļŗż ĻĖ┤ Ļ▓āņØĆ Ļ│Āņ▓┤ņØĖ NaClO3Ļ░Ć ņÖäņĀäĒ׳ ņÜ®ĒĢ┤ļÉśĻĖ░Ļ╣īņ¦Ć ņŗ£Ļ░äņØ┤ ĒĢäņÜöĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.
3.4 Ļ┤æņĢĪļåŹļÅäņØś ņśüĒ¢ź
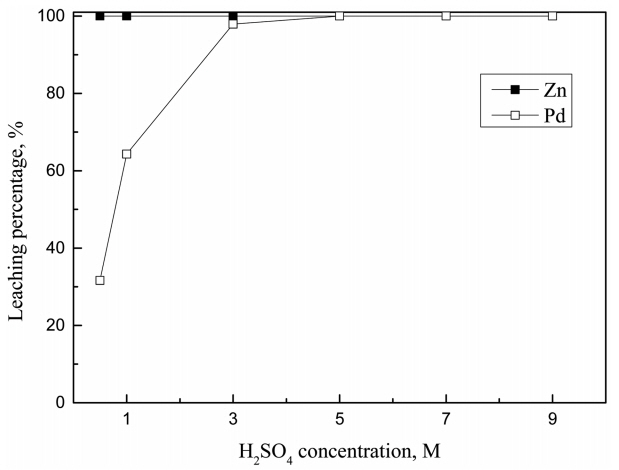
Ļ┤æņĢĪļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ Ļ┤æņĢĪļåŹļÅäļź╝ 1ņŚÉņä£ 10 g/LĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░ļŗż. ņØ┤ļĢī ņé░ ļåŹļÅä, ņé░ĒÖöņĀ£ ļåŹļÅä ļ░Å ļ░śņØæņś©ļÅäļŖö ņŗżĒŚśņØä ĒåĄĒĢ┤ ņ¢╗ņØĆ ņĄ£ņĀüņĪ░Ļ▒┤ņØä ņĀüņÜ®Ē¢łĻ│Ā, ņČ®ļČäĒĢ£ ļ░śņØæņØä ņ£äĒĢ┤ ļ░śņØæņŗ£Ļ░äņØĆ 1ņŗ£Ļ░äņ£╝ļĪ£ Ļ│ĀņĀĢĒ¢łņ£╝ļ®░, ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 5ņŚÉ ļéśĒāĆļāłļŗż. Ļ┤æņĢĪļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ Ļ░ÉņåīĒ¢łļŖöļŹ░, ņØ┤ļŖö ĒīöļØ╝ļōÉ ņ╣©ņČ£ņŚÉ ĒĢäņÜöĒĢ£ ņé░Ļ│╝ ņé░ĒÖöņĀ£ņØś ņ¢æņØ┤ ņČ®ļČäĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. 7 MņØś ņŚ╝ņé░ņŚÉ ņé░ĒÖöņĀ£ļĪ£ H2O2ļź╝ ņ▓©Ļ░ĆĒĢśļŖö Ļ▓ĮņÜ░ Ļ┤æņĢĪļåŹļÅä 5 g/LĻ╣īņ¦ĆļŖö ĒīöļØ╝ļōÉņØ┤ ļ¬©ļæÉ ņ╣©ņČ£ļÉśņŚłņ£╝ļéś, ĻĘĖ ņØ┤ĒøäņŚÉļŖö Ļ░ÉņåīĒĢśĻĖ░ ņŗ£ņ×æĒ¢łļŗż. ņØ┤ņŚÉ ļ░śĒĢ┤ ņŚ╝ņé░ņØś ļåŹļÅäĻ░Ć 3MĻ│╝ 0.5 M, ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5 MļĪ£ ņé░ņØś ļåŹļÅäĻ░Ć ļ╣äĻĄÉņĀü ļé«ņØĆ ņĪ░Ļ▒┤ņŚÉņä£ļŖö Ļ┤æņĢĪļåŹļÅäĻ░Ć 1ņŚÉņä£ 10 g/LļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ ĻĖēĻ▓®Ē׳ Ļ░ÉņåīĒ¢łļŗż. ņØ┤ļŖö ņ¦äĒĢ£ ņé░ņØ┤ ĒīöļØ╝ļōÉĻ│╝ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢśļŖöļŹ░ ņČ®ļČäĒĢ£ ņŚ╝ņåīņØ┤ņś©ņØä ņĀ£Ļ│ĄĒĢ┤ ĒÖśņøÉņĀäņ£äļź╝ Ļ░Éņåīņŗ£ņ╝£ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ļö░ļØ╝ņä£ Ļ┤æņĢĪļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļæöĒÖöņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ņä£ļŖö 7MņĀĢļÅäņØś ņ¦äĒĢ£ ņŚ╝ņé░ņÜ®ņĢĪņØä ņ╣©ņČ£ņÜ®ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗż. ĻĘĖļ¤¼ļéś 3 M HCl-1 g/L NaClO3 ņÜ®ņĢĪļ│┤ļŗż 0.5 M H2SO4-1.5% NaClO ņÜ®ņĢĪņŚÉņä£ ņé░ ļåŹļÅäĻ░Ć ļé«ņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ļźĀņØ┤ ļåÆņØĆ Ļ▓āņØĆ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņŚÉ NaClOĻ░Ć NaClO3ļ│┤ļŗż Ļ░ĢļĀźĒĢ£ ņé░ĒÖöņĀ£ļĪ£ ņ×æņÜ®ĒĢ£ļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż.
3.5 ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś ņ╣©ņČ£Ļ▒░ļÅÖ
ļ░▒ĻĖłņĪ▒ļź╝ ĒĢ©ņ£ĀĒĢ£ ņÜ®ņĢĪņŚÉ ņĢäņŚ░ĻĖłņåŹļČäļ¦ÉņØä ņ▓©Ļ░ĆĒĢ┤ ņ╣śĒÖśņŗ£ĒéżļŖö Ļ▓ĮņÜ░ ņ╣śĒÖśļ¼╝ņŚÉņä£ ļ░▒ĻĖłņĪ▒ ĻĖłņåŹņØś ĒĢ©ļ¤ēņØĆ 55 wt% ļ»Ėļ¦īņØ┤ļŗż [23]. ļö░ļØ╝ņä£ ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ņ╣©ņČ£ņØä ņ£äĒĢ£ ņĄ£ņĀüņĪ░Ļ▒┤ņŚÉņä£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ĻĖłņåŹņØä 1:1ļ╣äņ£©ļĪ£ Ēś╝ĒĢ®ĒĢ£ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØä ņżĆļ╣äĒĢ┤ ņ╣©ņČ£Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. ņé░ ļåŹļÅä, ņé░ĒÖöņĀ£ ļåŹļÅä, ļ░śņØæ ņś©ļÅäļŖö ĒīöļØ╝ļōÉ ļŗ©ļÅģĻĖłņåŹ ņ╣©ņČ£ņØä ņ£äĒĢ£ ņĄ£ņĀüņĪ░Ļ▒┤Ļ│╝ ļÅÖņØ╝ĒĢśĻ▓ī ņ£Āņ¦ĆĒ¢łļŗż. ņ”ē ņŚ╝ņé░ņØä ņ╣©ņČ£ņÜ®ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ņé░ĒÖöņĀ£ņØś ņĄ£ņĀüļåŹļÅäļŖö H2O2 : 0.5%, NaClO3 : 1 g/L, NaClO : 1%ņØ┤ņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņé░ĒÖöņĀ£ņØś ļåŹļÅäļź╝ ļ¬░ļåŹļÅäļĪ£ ĒÖśņé░ĒĢśļ®┤ Ļ░üĻ░ü 0.16, 0.47, 0.16 MļĪ£ NaClO3ļź╝ ņĀ£ņÖĖĒĢśļ®┤ ņé░ĒÖöņĀ£ņØś ļåŹļÅäņŚÉļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåļŗż. ļö░ļØ╝ņä£ ņĄ£ņĀüņØś ņé░ĒÖöņĀ£ ļåŹļÅäņŚÉņä£ ņŚ╝ņé░ņØś ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ ĻĖłņåŹņØś Ēś╝ĒĢ®ļ¼╝ņŚÉņä£ ļæÉ ĻĖłņåŹņØś ņ╣©ņČ£ļźĀņØä ņĪ░ņé¼Ē¢łļŗż. ĒĢ£ĒÄĖ ĒÖ®ņé░ņØä ņ╣©ņČ£ņÜ®ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ NaClOļ¦īņØ┤ ņé░ĒÖöņĀ£ļĪ£ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż. ļö░ļØ╝ņä£ ĒÖ®ņé░ņÜ®ņĢĪņØś Ļ▓ĮņÜ░ 1.5% NaClO(0.24 M)ļź╝ ņ▓©Ļ░ĆĒĢ┤ ĒÖ®ņé░ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝£ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś ņ╣©ņČ£ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż. ņØ┤ļĢī ņČ®ļČäĒĢ£ ļ░śņØæņØä ņ£äĒĢ┤ ļ░śņØæņŗ£Ļ░äņØĆ 1ņŗ£Ļ░ä, ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś Ļ┤æņĢĪļåŹļÅäļŖö 2 g/LļĪ£ Ļ│ĀņĀĢĒ¢łļŗż.
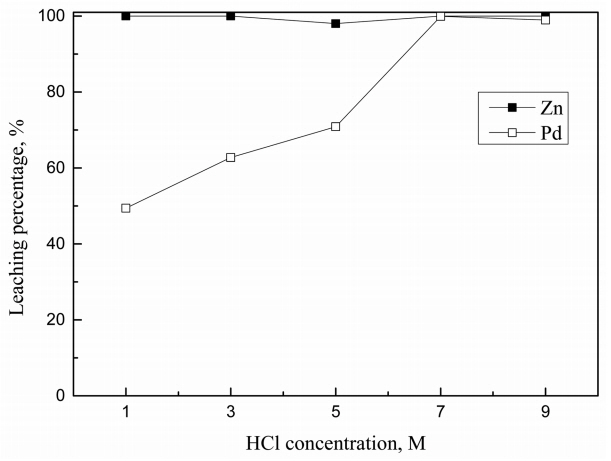
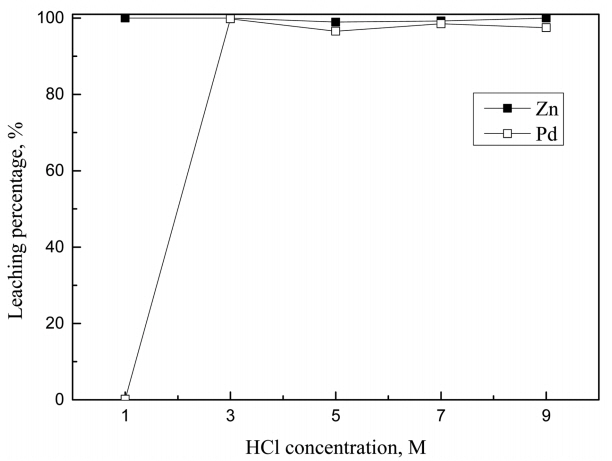
Ļ░üĻ░üņØś ņĄ£ņĀüņĪ░Ļ▒┤ņŚÉņä£ ņé░ ļåŹļÅäĻ░Ć ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś ņ╣©ņČ£ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ĻĘĖļ”╝ 6, 7, 8, 9ņŚÉ ļéśĒāĆļāłļŗż. ļ¬©ļōĀ ņ╣©ņČ£ņÜ®ņĢĪņŚÉņä£ ņé░ ļåŹļÅäĻ░Ć ļé«ņ£╝ļ®┤ ņĢäņŚ░ņØ┤ ĒīöļØ╝ļōÉļ│┤ļŗż ņäĀĒāØņĀüņ£╝ļĪ£ ņ╣©ņČ£ļÉÉļŗż. HCl-0.5% H2O2ņÖĆ HCl-1 g/L NaClO3 ņÜ®ņĢĪņØĆ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņØś ņĄ£ņĀüņĪ░Ļ▒┤Ļ│╝ ļÅÖņØ╝ĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ Ēś╝ĒĢ®ļ¼╝ņØä ņÖäņĀäĒ׳ ņ╣©ņČ£ĒĢ£ ļ░śļ®┤, NaClOļŖö Ēś╝ĒĢ®ļ¼╝ņØä ņÖäņĀäĒ׳ ņ╣©ņČ£ĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ ļ¬©ļæÉņŚÉņä£ ņĄ£ņĀüņĪ░Ļ▒┤ļ│┤ļŗż ļåÆņØĆ 5 M ņØ┤ņāüņØś ņé░ļåŹļÅäĻ░Ć ņÜöĻĄ¼ļÉÉļŗż. ņØ┤ļŖö ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ņĄ£ņĀü ņ╣©ņČ£ņĪ░Ļ▒┤ņØĖ 1 g/Lļ│┤ļŗż ļåÆņØĆ Ļ┤æņĢĪļåŹļÅäņŚÉņä£ 99% ņØ┤ņāü ņ╣©ņČ£ņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ļŹö ļ¦ÄņØĆ ņé░ņØ┤ ĒĢäņÜöĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ļŗ©ņØ╝ņ╣©ņČ£Ļ│╝ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś ņ╣©ņČ£Ļ▒░ļÅÖņØĆ ļīĆņ▓┤ņĀüņ£╝ļĪ£ ņ£Āņé¼Ē¢łņ£╝ļéś, ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ ņ╣©ņČ£ņŗ£ ņé░ļåŹļÅäĻ░Ć 7 M ņØ┤ņāüņØ┤ļ®┤ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ņØś ņ╣©ņČ£ļźĀņØ┤ ņĢĮĻ░ä Ļ░ÉņåīĒ¢łļŗż.
4. Ļ▓░ ļĪĀ
ļÅäĻĖł ĒÅÉņĢĪņŚÉņä£ ņĢäņŚ░ĻĖłņåŹļČäļ¦ÉļĪ£ ņ╣śĒÖśĒĢ£ ĒīöļØ╝ļōÉņØś ĒÜīņłś Ļ│ĄņĀĢņØä Ļ░£ļ░£ĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņŚÉņä£ ĒīöļØ╝ļōÉ ļŗ©ņØ╝ ĻĖłņåŹ ļ░Å ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ņØś ņ╣©ņČ£Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. ņé░ĒÖöņĀ£ļĪ£ H2O2, NaClO3, NaClOļź╝ ņ▓©Ļ░ĆĒ¢łņ£╝ļ®░, ņé░Ļ│╝ ņé░ĒÖöņĀ£ ļåŹļÅä, ļ░śņØæņś©ļÅä, ļ░śņØæņŗ£Ļ░ä ļ░Å Ļ┤æņĢĪļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝£ ņ╣©ņČ£Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ļŖö H2O2, NaClO3, NaClOĻ░Ć ĒīöļØ╝ļōÉ ņ╣©ņČ£ņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłņ£╝ļéś, ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļŖö NaClOļ¦ī ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż. ļśÉĒĢ£ H2O2 ļ░Å NaClO3ļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ 60 ┬░C ņØ┤ņāüņØś ļ░śņØæņś©ļÅäĻ░Ć ĒĢäņÜöĒ¢łļŗż. ļ░śļ®┤ NaClOļŖö ņāüņś©ņØś ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņØ┤ Ļ░ĆļŖźĒ¢łļŗż. ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņ¢╗ņØĆ ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņØä ņ£äĒĢ£ ņĄ£ņĀüņĪ░Ļ▒┤ņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. 7 M HCl-0.5% H2O2 : ļ░śņØæņŗ£Ļ░ä 60ļČä, ļ░śņØæņś©ļÅä 60 ┬░C, 3 M HCl-1 g/L NaClO3 : ļ░śņØæņŗ£Ļ░ä 30ļČä, ļ░śņØæņś©ļÅä 40 ┬░C, 0.5 M HCl-1%NaClO : ļ░śņØæņŗ£Ļ░ä 20ļČä, ļ░śņØæņś©ļÅä 25 ┬░C, 0.5 M H2SO4-1.5%NaClO : ļ░śņØæņŗ£Ļ░ä 20ļČä, ļ░śņØæņś©ļÅä 25 ┬░C.
ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ ĻĖłņåŹņØś Ēś╝ĒĢ®ļ¼╝ņØä ņ╣©ņČ£ņŗ£ ņé░ĒÖöņĀ£ļĪ£ H2O2ņÖĆ NaClO3ļź╝ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ĒīöļØ╝ļōÉņØä ļ¬©ļæÉ ņÜ®ĒĢ┤ņŗ£ĒéżļŖö ņĪ░Ļ▒┤ņØĆ ļŗ©ņØ╝ ĻĖłņåŹņØś ņĪ░Ļ▒┤Ļ│╝ ļÅÖņØ╝ĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ņé░ĒÖöņĀ£ļĪ£ NaClOļź╝ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ļŗ©ņØ╝ ĻĖłņåŹĻ│╝ ļŗ¼ļ”¼ ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ļåŹļÅäļź╝ 5 M ņØ┤ņāüņ£╝ļĪ£ ņ£Āņ¦ĆĒĢ┤ņĢ╝ ĒīöļØ╝ļōÉņØ┤ ļ¬©ļæÉ ņÜ®ĒĢ┤ļÉśņŚłļŗż. ņŚ╝ņé░ņÜ®ņĢĪņ£╝ļĪ£ ĻĖłņåŹĒś╝ĒĢ®ļ¼╝ ņ╣©ņČ£ņŗ£ ļ╣äĻĄÉņĀü ļé«ņØĆ ļåŹļÅäņØś H2O2ļĪ£ ĒīöļØ╝ļōÉņØä ļ¬©ļæÉ ņ╣©ņČ£ĒĢśļŖö Ļ▓āņØ┤ Ļ░ĆļŖźĒĢśļŗż. ĻĘĖļ”¼Ļ│Ā ĒÖ®ņé░Ļ│╝ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ NaClOļŖö ņāüņś©ņŚÉņä£ ņ¦¦ņØĆ ņŗ£Ļ░ä ņĢłņŚÉ ĒīöļØ╝ļōÉņØä ļ¬©ļæÉ ņ╣©ņČ£ņŗ£ĒéżļŖö Ļ▓āņØ┤ Ļ░ĆļŖźĒ¢łļŗż.