AbstractA novel magnesium (Mg) production process utilizing an electrolytic method was investigated for the direct reduction of magnesium oxide (MgO). Electrolysis of MgO was carried out with an applied voltage of 3.0 V using a copper (Cu), silver (Ag), or tin (Sn) cathode and carbon (C) or platinum (Pt) anode in magnesium fluoride (MgF2)−calcium fluoride (CaF2)−sodium fluoride (NaF) at 1273 K or MgF2− lithium fluoride (LiF) at 1083−1093 K. After the electrolysis of MgO in MgF2−CaF2−NaF molten salt, Mg alloys such as Mg2Cu, Cu2Mg, or Mg2Sn phases were produced with current efficiencies of 75.8−85.6% when the concentration of Mg in Mg alloys was 9.1−14.6 mass%. In addition, when the electrolysis of MgO was conducted in MgF2–LiF molten salt, Mg alloys such as Mg2Cu or AgMg phase were produced with current efficiencies of 76.2−81.7% when the concentration of Mg in the Mg alloys was 12.5−13.2 mass%. In addition, to produce high-purity Mg metal from Mg alloys, vacuum distillation was conducted. When vacuum distillation was conducted at 1100−1400 K for a duration of 5 h, the concentration of Mg in the Mg alloys feed decreased from 30.2−34.1 mass% to 0.64−1.75 mass%, and Mg metal with a purity of 99.998−99.999% was obtained under certain conditions. Therefore, the molten salt electrolysis using liquid metal cathode (MSE-LMC) process developed here is feasible for the direct reduction of MgO using an effective and environmentally sound method.
1. 서 론마그네슘(Mg)은 구조재료 중 가장 가벼운 금속으로 높은 비강도, 우수한 주조성과 기계 가공성으로 인해 수송기기, 전자제품, 휴대용 공구류, 군수용품 등 다양한 분야에서 널리 사용되고 있다 [1-4]. 특히, 수송기기의 경량화 및 연비향상을 위한 대책으로 Mg 제품에 대한 관심이 증가하고 있어, Mg의 수요는 지속적으로 증가할 것으로 예상된다 [4,5].
상용 Mg 생산 공정은 열환원법과 전기분해법으로 구분되며, 현재 세계 Mg의 약 85%는 열환원법 중 하나인 Pidgeon 공정에 의해 중국에서 생산되고 있다 [6]. Pidgeon 공정은 백운석(MgCO3·CaCO3)을 하소한 후 1373−1473 K에서 페로실리콘(Fe·Si)을 환원제로 사용하여 진공 분위기에서 열환원 반응을 통해 Mg을 생산하는 기술이다[7-9]. 하지만, Pidgeon 공정은 생산성이 낮고, 높은 에너지 소비와 노동력이 필요하며, 공정 중 다량의 황산화물(SOx) 및 이산화탄소(CO2) 가스가 발생하는 단점이 있다 [9-11].
전기분해법은 염수에서 얻은 무수 염화마그네슘(MgCl2) 또는 무수 carnallite (MgCl2·KCl)를 928−993 K에서 용융염전해를 통해 Mg을 생산하는 방법이다 [9]. 열환원법과 비교하여 온실가스 발생이 적은 장점이 있지만, 무수 MgCl2 제조에 많은 에너지가 필요하고, 음극으로 사용하는 철(Fe)로 인해 생산된 Mg에 Fe이 함유되어 Mg의 내식성 감소의 원인이 되며, 전해 중 염소(Cl2) 가스가 발생하는 단점이 있다 [9,12].
이와 같은 기존 상용 Mg 생산 공정의 단점을 개선하기 위한 Mg 신 제련법 개발에 관한 많은 연구가 수행되고 있으며, 특히 공정에너지 저감과 환경적 문제를 극복하기 위한 방안으로 산화마그네슘(MgO)을 원료로 사용하는 Mg 신제련법 개발에 관한 다양한 연구가 진행되고 있다 [13-17]. 개발된 Mg 신제련법 중 미국 보스턴대학의 Pal 교수 연구팀의 solid oxide membrane (SOM)을 이용한 MgO의 용융염 전해기술이 많은 주목을 받고 있다. SOM 공정은 MgO을 원료로 사용하기 때문에, 무수 MgCl2 제조 공정이 필요 없으며, 공정 중 양극에서 산소(O2) 가스가 발생하는 친환경적인 공정이다. 하지만, 멤브레인으로 사용되는 yttria-stabilized zirconia (YSZ) 튜브의 가격이 비싸고, 공정 중 열 충격에 의한 파손 및 재질 열화가 발생하며, 전해 시 아르곤(Ar) 가스 bubbling을 하지 않으면 전류효율이 90%에서 40−50%로 감소하는 단점이 있다 [15-17]. 따라서 이와 같은 기존 Mg 제련법의 단점을 개선할 수 있는 친환경적이며 고효율의 Mg 신제련법 개발이 필요하다.
이에 본 연구팀은 MgO 원료로부터 고순도 Mg 금속 제조를 위해 액체금속 음극을 이용한 용융염전해(Molten Salt Electrolysis using Liquid Metal Cathode, MSELMC)법을 개발하였다 [18-20]. MSE-LMC법을 이용한 고순도 Mg 금속 제조는 그림 1과 같이, 1053−1083 K에서 MgO의 용융염전해를 통해 음극과 Mg의 합금을 형성하는 공정과 이를 통해 형성된 Mg 합금을 1200−1400 K에서 진공증류를 통해 고순도 Mg 금속을 생산하는 공정으로 이루어진다.
MSE-LMC법의 경우 MgO의 용융염전해 시 불화마그네슘(MgF2)−불화리튬(LiF) 용융염을 사용하고 있다. 한편 SOM법의 경우 MgO의 용융염전해 시 MgF2 또는 MgF2−불화칼슘(CaF2) 용융염을 사용하고 있으며 최근 SOM 공정온도인 1423 K보다 낮은 온도인 1273 K에서 SOM법을 적용하기 위해 MgF2−CaF2−불화나트륨(NaF) 용융염에 관한 연구가 이루어졌다 [21]. MSE-LMC법에서 MgF2−LiF 용융염 사용 시 MgF2−CaF2−NaF 용융염 사용 대비 전해온도를 낮출 수 있어 Mg 증기압이 낮아지기 때문에 Mg 합금 생성 시 합금 내 최대 고용 가능한 Mg 함량이 증가하나 용융염 내 MgO의 용해도는 감소하게 된다 [22]. 따라서 본 연구에서는 용융염 종류가 MSE-LMC법을 이용한 MgO의 용융염전해에 미치는 영향에 대한 기초연구를 수행하였다. 또한, Mg 합금으로부터 고순도 Mg 금속을 제조하기 위한 진공증류 시 Mg 회수율 향상을 위해 온도가 진공증류에 미치는 영향에 관한 기초연구를 수행하였다.
2. MSE-LMC법의 원리MSE-LMC법은 그림 2와 같이 액체금속 음극을 이용하여 불화물계 용융염에서 MgO을 원료로 사용한 용융염전해를 통해 Mg 합금을 제조하는 방법이다. MgO의 용융염전해를 통해 환원된 Mg은 전해셀 바닥의 고밀도 금속 음극과 반응하여 액상의 합금을 형성하게 되며, 전극에서의 반응식은 식 (1)−(4)와 같다. MSE-LMC법을 통해 형성된 Mg 합금은 진공 증류법을 이용한 음극용 금속과의 분리를 통해 조건에 따라 순도 99.999%의 초고순도 Mg 금속 생산이 가능하다 [18]. 이처럼 MSE-LMC법은 MgO을 원료로 사용하기 때문에, 무수 MgCl2 제조가 필요 없으며, 불활성 양극을 사용할 경우 전해 중 O2 가스가 발생한다. 액체금속 음극의 사용은 전해 중 환원된 Mg과 양극에서 발생하는 가스의 재반응을 억제하여 높은 전류효율을 얻을 수 있다. 또한, 전해셀의 구조가 상용 알루미늄(Al) 생산시 사용되는 전해셀과 원리적으로 동일한 구조이기 때문에 상용화 시에도 유리하다. 마지막으로 MSE-LMC법을 통해 제조된 Mg 합금으로부터 진공증류를 통해 순도 99.999%의 초고순도 Mg 금속을 생산할 수 있다.
Cathode:
Anode:
용융염의 성분 및 조성은 MgO의 용해도, 용융염의 용융온도 및 분해전압을 고려하여 설계하였다. MSE-LMC법에 사용된 용융염 조성은 54 mass% MgF2-46 mass% LiF의 2원계 혼합염 및 45 mass% MgF2-45 mass% CaF2-10 mass% NaF의 3원계 혼합염을 사용하였다. MgF2−CaF2−NaF 혼합염은 저온 SOM법에서 사용하기 위해 개발된 전해질 조성이며[21], 표 1은 다양한 불화물계염 및 MgO의 1083 K 및 1273 K에서의 표준분해전압을 계산한 결과이다 [23]. 본 연구에서는 3원계 및 2원계 용융염의 상태도를 이용하여 MgF2−CaF2−NaF 용융염을 사용할 경우 1273 K, MgF2−LiF 용융염을 사용할 경우 1083−1093 K를 전해온도로 선택하였다.
MSE-LMC법에 사용되는 음극의 경우, 전해셀 바닥에서 환원된 Mg 금속과 합금을 형성해야 하기 때문에 Mg 금속보다 밀도가 큰 금속이어야 한다. 그리고 공정비용 및 공정 안정성을 고려하여 독성이 있는 금속, 희소금속이나 값비싼 금속의 사용은 어렵다. 또한, Mg 고용도가 커야하며, 전해온도에서 Mg 합금 내 Mg의 증기압(pMg)이 낮아 전해 중 Mg이 증발되지 않아야 하며, Mg과 증기압 차이가 커서 진공증류를 통해 쉽게 Mg과 분리할 수 있는 금속이어야 한다. 그림 3은 Mg 금속과 주요 금속의 온도에 따른 증기압 변화를 나타낸 결과이다 [23]. 본 연구에서는 이와 같은 조건을 만족하는 구리(Cu), 은(Ag), 주석(Sn)을 음극용 금속으로 선정하여 사용하였다. 양극 소재는 상용화 공정에서 주로 사용되는 흑연(C)과 불활성 양극 소재 개발을 고려한 백금(Pt)을 사용하였다.
MSE-LMC법은 그림 2와 같이 용융염전해 시 환원된 Mg 금속과 음극용 금속이 합금을 형성하기 때문에, pMg, Mg 합금 밀도(ρalloy)와 용융염 밀도(ρsalt)가 매우 중요하다. 그림 4는 Mg−X (X = Cu, Ag, Sn) 합금 내 Mg의 함량 및 온도에 따른 pMg 변화를 상태도와 함께 나타낸 그림이다 [24]. 일반적으로 어떤 물질의 증기압이 0.01 atm보다 크면, 해당 물질의 증발이 활발하게 일어난다 [25]. 그림 4에서 알 수 있듯이 용융염전해가 진행됨에 따라 Mg 합금 내 Mg 함량이 증가하여 pMg이 증가하게 되고, 증기압이 0.01 atm 이상이 되면 Mg의 증발이 발생하여 전류효율 감소의 원인이 된다. 따라서 pMg 고려 시 1273 K의 MgF2−CaF2−NaF 용융염에서 Cu, Sn, Ag을 음극으로 사용한 전해 시 Mg 합금 내 Mg 최대 조성은 각각 7.9, 7.2, 7.0 mass%이다. 반면, 1083 K의 MgF2−LiF 용융염에서 Cu, Sn, Ag을 음극으로 사용한 전해 시 Mg 합금 내 Mg 최대 조성은 각각 24.4, 26.7, 20.9 mass%이다.
또한, 그림 4를 통해 Mg−X 합금의 진공증류 시 최적 온도를 결정할 수 있다. 일반적으로 pMg이 0.01 atm보다 크면, Mg의 증발이 활발히 발생한다. 하지만, 반응계의 압력이 1 atm보다 작은 경우 Mg은 0.01 atm보다 낮은 증기압에서도 증발이 활발히 일어난다 [25]. 따라서, 진공증류 공정에서 pMg이 0.0001−0.001 atm 범위에서도 Mg−X 합금 내 Mg은 증발할 것으로 예상된다. 따라서 Mg−X 합금에서 Mg 회수 시 충분한 시간 동안 진공증류가 수행된다면 음극 소재에 따라 1200−1300 K가 최적 진공증류 온도로 예상된다.
마지막으로 전해가 진행됨에 따라 형성된 Mg 합금의 밀도가 낮아져 용융염 위로 부양되는 것을 방지하기 위해 ρalloy와 ρsalt에 대한 고려가 필요하다. MgF2−CaF2−NaF 용융염과 MgF2−LiF 용융염에 염 질량의 10 mass% MgO 첨가 시 이론 밀도는 각 3.13 g/cm3과 2.93 g/cm3이다. 반면, Mg 합금 내 Mg 조성이 30 mass%일 때 Cu−Mg, Sn−Mg, Ag−Mg 합금의 이론 밀도는 각 3.61, 3.45, 3.78 g/cm3이다. 따라서 2원계 및 3원계 용융염을 사용할 경우, pMg를 고려한 Mg 합금 내 Mg의 최대 조성까지 전해셀 바닥에서 Mg 합금의 생산이 가능하다.
3. 실험 방법3.1 MgO의 용융염전해
그림 5는 MSE-LMC법을 이용한 MgO 용융염전해에 사용된 반응기의 모식도 및 사진이다. MgF2 (anhydrous, purity > 99.9%, powder, Kojundo Chemical Inc.)−CaF2 (anhydrous, purity > 99.9%, powder, Kojundo Chemical Inc.)−NaF (anhydrous, purity > 99.9%, powder, Kojundo Chemical Inc.) 혼합염 또는 MgF2−LiF (anhydrous, purity > 99.9%, powder, Kojundo Chemical Inc.) 혼합염과 혼합염의 10 mass% MgO (purity > 99.99%, powder, Kojundo Chemical Inc.)을 알루미나(Al2O3) 도가니(purity > 99.8%, ϕ = 51 mm, O.D., t = 3.0 mm, thickness, h = 73.0 mm, height)에 담은 후 Al2O3 도가니를 quartz 반응기 (ϕ = 60 mm, t = 2.0mm, h = 650 mm)에 장입하였다. 음극용 금속은 Al2O3 (purity > 99.5%, ϕ = 18 mm, t = 1.5mm, h = 25mm) 또는 MgO 도가니 (purity > 99.4%, ϕ = 18 mm, t = 1.5 mm, h = 25 mm)에 장입하여 사용하였으며, 양극은 C (ϕ = 8 mm, SGL carbon Group) 또는 Pt (ϕ = 1 mm, purity = 99.99%, Alfa Aesar chemical)을 사용하였다.
전극은 니켈(Ni) 와이어(potential lead)와 연결 후 Al2O3 관에 넣고 한쪽 끝을 Al2O3 기반 접착제를 사용하여 밀봉하였으며 사용 전 상온에서 24시간 건조 후, 진공 분위기의 363 K에서 2시간, 423 K에서 2시간, 773 K에서 5시간 건조하였다. 건조 후 실리콘 플러그를 이용하여 Al2O3 관의 한쪽 끝을 밀봉 후 ultra-torr vacuum fitting을 이용하여 반응기 상부 실리콘 플러그에 고정시켰다. 이후 진공 펌프를 이용하여 10분간 반응기 내부 공기를 제거 후, Ar 가스 (purity = 99.9999%)를 반응기 내부 압력이 1 atm에 도달할 때까지 주입하였으며, 전해 중 반응기 내부 압력이 1 atm을 유지할 수 있도록 Ar 가스를 흘려주었다.
이후, 반응기를 세로형 전기로에 장입 후 용융염의 조성에 따라 1083−1273 K로 승온 후 실험을 실시하였다. MgO의 용융염전해는 potentiostat (Model no.: VMP3, booster: VMP3B, 2A−20V, Biologic Science Instruments)을 이용하여 3.0 V의 셀 전압을 인가하여 실험을 진행하였으며, 실험 조건은 표 2와 같다. 실험 종료 후, 음극과 양극을 용융염으로부터 분리 후 반응기는 전기로에서 분리하여 공기 중에서 냉각하였다. Mg 합금을 Al2O3 또는 MgO 도가니에서 분리하여 표면의 염을 제거 후 성분, 미세조직 및 결정구조 분석을 진행하였다.
3.2 Mg 합금의 진공증류Mg과 음극 소재인 Cu, Ag, 또는 Sn과의 증기압 차이에 의한 Mg 합금으로부터 Mg 금속 회수를 규명하기 위하여 모의 Mg 합금의 진공증류를 실시하였다. Mg−Cu 합금, Mg−Ag 합금, 그리고 Mg−Sn 합금 원료는 각각 1023−1073 K에서 4−5시간, 1023−1073 K에서 5−7시간, 그리고 1013 K에서 15시간 전기로 또는 고주파 용해로를 이용하여 진공 분위기에서 제조하였다.
그림 6은 진공증류에 사용된 반응기의 모식도 및 사진이다. 제조된 Mg 합금을 반응기 하부에 장입 후, 실리콘 플러그를 사용하여 반응기 상부를 막은 후 진공 펌프를 이용하여 실험 중 반응기 내부의 진공을 유지하였다. 이후 1100−1400 K로 가열된 전기로에 반응기를 장입하여 5시간 진공증류 실험을 진행하였다. 실험 종료 후 즉시 반응기를 전기로에서 분리하여 공기 중에서 상온까지 냉각 후 반응기를 절단하여 샘플을 회수하였다.
3.3 샘플 분석Mg 합금 및 진공증류 후 반응기 내 잔사의 성분분석은 유도결합플라즈마 방출분광기 (ICP-OES, Optima 5300DV, Perkin Elmer)를 사용하여 분석하였으며, Mg 순금속의 순도는 글로우 방전 질량분석기 (GD-MS, GD90RF, MSI)를 사용하여 분석하였다. 미세조직은 장방출 주사전자현미경(FE-SEM, JSM-7000F, JEOL)과 에너지분산형 분광분석법(EDS, INCA, Oxford Instruments)을 사용하여 분석하였다. 또한, Mg 합금의 결정구조는 X선회절분석기(XRD, SmartLab, Rigaku, Cu-Kα radiation)를 사용하여 분석하였다.
4. 결과 및 고찰4.1 MgO의 용융염전해
표 3은 MSE-LMC법을 이용한 MgO 용융염전해 실험결과 및 음극에서 회수된 Mg 합금의 성분분석 결과이다. 전류효율 계산을 위한 이론적 Mg 전착량(MgTheo)은 식 (5)를 사용하여 계산하였다.
여기서 MMg는 Mg의 몰질량(24.305 g/mol), i는 전류, t는 전해시간, n은 Mg 이온가(n = 2), F는 패러데이 상수(96485.3 s·A/mol)이다.
음극에서 형성된 Mg 합금의 성분분석을 통해 전류효율을 분석한 결과, 1273 K의 MgF2−CaF2−NaF 용융염에서 MgO 전해 시, Mg 합금 내 Mg 함량이 9.1−14.6 mass%일 때 전류효율은 75.8−85.6%였다. 또한, 1083−1093 K의 MgF2−LiF 용융염에서 MgO 전해 시, Mg 합금 내 Mg 함량이 12.5−13.2 mass%일 때 76.2−81.7%의 전류효율을 나타냈다. 이와 같은 결과로부터 Mg 합금 내 Mg 함량이 14.6 mass% 이하일 경우 1083−1273 K의 전해온도 범위 내에서 전류효율 차이는 크게 나타나지 않았다.
양극 소재가 전류효율에 미치는 영향을 분석하기 위해 Cu−Pt (Exp. no. 180319) 및 Cu−C 전극 (Exp. no. 180327)을 사용한 MgO 전해실험을 실시하였다. 표 3의 실험결과에서 볼 수 있는 것과 같이 1273 K의 MgF2−CaF2−NaF 용융염에서 Cu−Pt 및 Cu−C 전극을 이용한 전해 시 전류효율은 각 85.6%와 84.5%로 양극 소재가 전류효율에 미치는 영향은 크지 않은 것으로 분석되었다. 이와 같은 결과로부터 양극에서 COx 가스가 발생할 경우 뿐만 아니라 O2 가스가 발생하더라도 환원된 Mg이 전해셀 바닥에서 음극과 Mg 합금을 형성하기 때문에 양극에서 생성된 활성 가스(Reactive gases)와의 재반응에 의한 전류효율 저하가 억제되는 것을 알 수 있다.
음극 소재가 전류효율에 미치는 영향을 분석하기 위해 1273 K의 MgF2−CaF2−NaF 용융염에서 Cu−Pt (Exp. no. 180319) 및 Sn−Pt 전극 (Exp. no. 180326)을 사용하여 MgO 전해를 실시하였다. Cu 및 Sn 음극을 사용하였을 때 전류효율은 각 85.6%와 75.8%로 Cu 음극을 사용한 경우 전류효율이 9.8%p 높게 나타났다. 이는 앞선 MSELMC법의 원리에서 설명한 것과 같이 1273 K에서 Cu 음극 사용 시 Sn 음극 사용 대비 Mg 합금 내 고용 가능한 Mg 최대 조성값이 크기 때문에 전해에 의한 Mg 합금 형성 시 Mg 휘발에 의한 Mg 손실이 적었기 때문으로 판단된다.
또한, 1083−1093 K의 MgF2−LiF 용융염에서 Ag−C (Exp. no. 180525) 및 Cu−C 전극 (Exp. no. 180723)을 사용한 MgO 전해 결과, 전류효율은 각 81.7%와 76.2%로 Ag 음극 사용 시 전류효율이 5.5%p 높게 나타났다. 1083 K에서 Cu 및 Ag 음극 사용 시 Mg 합금 내 고용 가능한 Mg 최대 조성값 분석결과를 고려할 경우 Cu 음극 사용 시 Ag 음극 사용 대비 전류효율이 클 것으로 예상되었으나 실험결과에서는 Ag 음극 사용 시 전류효율이 큰 것으로 나타났으며, 이와 같은 결과와 관련, 구체적 원인에 대한 추가적 분석이 필요하다.
본 연구에서 Mg 신제련법으로 개발한 MSE-LMC법을 이용하여 1083−1273 K의 MgF2−CaF2−NaF 및 MgF2−LiF 용융염에서 MgO 전해 시 Mg 합금 내 Mg 함량이 9.1−14.6 mass%일 경우 전류효율은 75.8−85.6%였다. 또한, 실험 조건에서 전해온도와 양극 소재는 전류효율에 큰 영향을 미치지 않았다. 하지만 음극 소재에 따라 Mg 합금 내 Mg의 pMg의 영향 등에 의해 전류효율은 5.5−9.8%p의 차이를 나타냈다. 그림 4와 같이 pMg은 동일 조건에서 전해온도와 Mg 합금 내 Mg 함량이 증가할수록 증가하며 pMg 증가는 전류효율 저하로 이어진다. 따라서 일정 전해온도에서 음극 소재에 따른 Mg 합금 내 Mg 함량 증가 시 전류효율에 미치는 영향에 관한 추가적인 연구가 필요하다.
그림 7은 1273 K의 MgF2−CaF2−NaF 용융염에서 Cu 또는 Sn 음극과 C 또는 Pt 양극을 이용하여 MgO 전해 후 음극에서 회수된 Cu−Mg 및 Sn−Mg 합금의 XRD 분석결과이다. 그림 7(a)와 같이 9.8 mass% Mg−Cu 합금의 경우, Cu2Mg, Mg2Cu, Cu (Mg) 상이 나타났으며 14.6 mass% Mg−Cu 합금의 경우 그림 7(b)와 같이 Cu2Mg와 Cu (Mg) 상이 나타났다. 또한, Sn 음극을 사용하였을 경우 그림 7(c)와 같이, Mg2Sn와 Sn (Mg) 상이 나타났다. 이처럼, Sn−Mg 합금 내 형성된 상과 Cu-Mg 합금 중 형성된 Cu2Mg와 Cu (Mg) 상은 그림 4(a)와 (c)의 Cu−Mg 및 Sn−Mg 상태도에서 Mg 조성에 따른 예측 결과와 동일한 상이 형성되었음을 알 수 있다. 그러나 9.8 mass% Mg−Cu 합금의 경우, Mg−Cu 합금 내 Mg 함량이 약 18 mass% 이상 시 형성될 수 있는 Mg2Cu 상이 관찰되었다.
그림 8은 1273 K에서 MgO의 용융염전해 후 음극에서 회수된 Cu−Mg 합금과 Sn−Mg 합금의 미세조직 분석결과이다. 그림 8을 통해 알 수 있듯이, Cu와 Sn을 음극으로 사용하였을 경우, 전해를 통해 형성된 Mg 합금은 XRD 분석결과와 동일하게 Mg-rich 상과 Cu-rich 또는 Sn-rich 상으로 구분된다. 그림 8(a)에서와 같이 미세조직 분석 시 9.8 mass% Mg−Cu 합금에서 검출된 Mg2Cu 및 Cu2Mg 상의 구분은 어려웠다. Mg2Cu 상 형성은 전해 중 환원된 Mg이 음극인 Cu 표면부터 확산을 통해 합금화가 진행되는데, 충분한 합금화가 진행되지 않아 국부적으로 Mg2Cu 상이 관찰된 것으로 예상된다. 반면 상대적으로 Mg 함량이 높은 14.6 mass% Mg−Cu 합금의 경우 그림 4(a)에서 알 수 있는 것과 같이 액상이 안정한 영역으로 충분한 Mg과 Cu의 합금화가 진행되었기 때문에 Mg2Cu 상이 검출되지 않은 것으로 판단된다. 또한, 그림 8(a)와 (b)를 통해 확인할 수 있듯이, 상대적으로 Mg 함량이 적은 9.8 mass% Mg−Cu 합금의 경우, Cu-rich 상 영역이 14.6 mass% Mg−Cu 합금과 비교하여 조대하게 나타나기 때문에 충분한 합금화가 이루어지지 않은 것을 확인할 수 있다. Sn을 음극으로 사용한 9.0 mass% Mg−Sn 합금의 경우, Sn의 낮은 용융온도 (505 K)로 인해 그림 4(c)에서 알 수 있는 것과 같이 전해 전 과정에서 액상이 안정하다. 따라서 Mg 합금 내 Mg 함량이 낮음에도 불구하고 충분한 합금화가 진행되어 Mg2Sn과 Sn (Mg) 상이 형성되었음을 알 수 있다.
그림 9은 1083−1093 K의 MgF2−LiF 용융염에서 Ag 또는 Cu 음극과 C 양극을 사용하여 MgO 전해 후 음극에서 회수된 Ag−Mg 및 Cu−Mg 합금의 XRD 분석결과이다. XRD 분석결과, 13.2 mass% Mg−Ag 합금은 AgMg 단일 상이 형성되었으며, 12.5 mass% Mg−Cu 합금은 Cu2Mg와 Cu (Mg) 상이 형성됨을 알 수 있다. 그림 10는 1083 K와 1093 K에서 MgO의 전해 후 음극에서 회수된 Ag−Mg과 Cu−Mg 합금의 미세조직 분석결과이다. 그림 10(a)에서 알 수 있듯이 Ag−Mg 합금은 단일상으로 존재하는 것을 확인할 수 있고, Cu−Mg 합금은 1.2 mass% Mg−Cu 상과 15.4 mass% Mg−Cu 상으로 구분된다. 이러한 결과는 그림 4(a)와 (b)의 상태도에서 Mg 조성에 따른 예측 결과와 동일한 상이 형성되었음을 알 수 있다.
표 3에서 볼 수 있는 것과 같이 MgO의 용융염전해 후 음극에서 회수된 모든 Mg 합금에 0.01−0.1 mass%의 Al이 존재하는 것을 확인할 수 있다. 이는 전해 시 Mg 합금을 담고 있는 Al2O3 도가니 또는 Al2O3 관의 환원에 기인한 것으로 예상된다. 예를 들어 식 (6)과 같이 Mg 합금 내 Mg이 Al2O3 도가니 또는 Al2O3 관과 반응을 통해 Al이 생성되고 [23], 생성된 Al이 Mg 합금에 고용되면서 불순물로 남게 된다. 그러나 환원된 Mg 금속이 음극 금속과 합금을 형성하여 Mg의 활동도가 Mg 순금속 대비 낮고, Al2O3 도가니 사용 시 식 (6)에 의해 생성된 MgO와 도가니의 반응으로 MgxAlOy와 같은 산화물층이 형성되기 때문에 전해 후 Mg 합금을 담고 있는 Al2O3 도가니의 파손은 일어나지 않았던 것으로 판단된다. 전해셀의 구조적 안정성은 매우 중요한 이슈로써 전해온도, 용융염 성분 및 조성, 음극 종류 및 Mg 합금 내 Mg 조성이 Al2O3의 안정성에 미치는 영향에 대한 추가적 연구가 필요하다.
(Exp. no. 180327)
(Exp. no. 180525)
또한, 표 3에서 볼 수 있듯이 MgO의 용융염전해 시 전류효율은 75.8−85.6%를 나타냈다. 이는 불순물의 전착, 형성된 Mg 합금에서 Mg의 증발, 그리고 Mg 합금과 Al2O3 도가니/관의 반응 등으로 인해 전류효율이 100%에 이르지 못한 것으로 사료된다 [18].
1083−1273 K의 MgF2−CaF2−NaF 및 MgF2−LiF 용융염에서 Cu, Ag 또는 Sn 음극 및 C 또는 Pt 양극을 이용한 MgO 전해 실험결과, 본 논문에서의 실험 조건에서는 75.8% 이상의 전류효율을 얻을 수 있었다. 하지만, MgF2−CaF2−NaF 용융염을 사용할 경우 전해온도는 1273 K로 MgF2−LiF 용융염을 사용하였을 경우보다 190 K가 높다. 높은 전해온도는 전해에 사용되는 에너지 증가 및 전해셀의 구조재 안정성 저하 등과 밀접한 관련이 있으므로 낮은 온도에서 전해하는 것이 바람직하다. 또한, 표 3과 같이 Mg 합금 내 Mg 농도가 14.6 mass% 이하에서는 용융염 종류에 따라 매우 큰 전류효율 차이는 나타나지 않았으나, 그림 4와 같이 전해온도가 증가함에 따라 pMg가 증가하기 때문에 전해 중 쉽게 Mg의 증발이 발생할 수 있으며, 음극에서 Mg의 최대 고용 한도가 감소한다. 따라서 공정에너지, 안정성 및 공정 효율성 측면 고려 시 상대적으로 낮은 온도에서 전해가 가능한 MgF2−LiF 용융염 사용이 유리하다고 판단된다.
4.2 Mg 합금의 진공증류Mg 합금에서 고순도 Mg 금속을 제조하기 위하여 Mg 합금의 진공증류를 수행하였다. 표 4는 Mg 합금의 진공증류 실험 조건과 진공증류를 통해 제조된 Mg 금속과 반응기 하부에서 회수된 잔사의 성분분석 결과이다.
Mg−Cu 합금의 진공증류는 1200−1400 K에서 5시간 진행하였다. 표 4와 같이 1200−1300 K에서 5시간 진공증류 시 Mg−Cu 합금 내 Mg의 농도는 33.9−30.2 mass%에서 7.02−7.48 mass%로 감소하였으며, 반응기 저온부에서 순도 99.965−99.995%의 Mg 금속을 회수하였다. 그림 11은 1200 K에서 반응기의 온도 구배 및 진공증류 후 회수된 Mg 금속과 잔사의 사진이다. Mg의 회수율을 향상시키기 위해 1400 K에서 5시간 진공증류를 실시한 결과, Mg−Cu 합금 내 Mg의 농도는 0.64 mass%로 감소하였으며, 반응기 저온부에서 순도 99.999%의 Mg 금속을 회수할 수 있었다. 이를 통해 Mg−Cu 합금을 1400 K에서 5시간 진공증류 시 Mg을 효율적으로 회수할 수 있음을 알 수 있다.
Mg−Ag 합금의 진공증류는 1100−1300 K에서 5시간 진행하였다. 표 4와 같이, 1100 K와 1200 K에서 진공증류 시 Mg−Ag 합금 내 Mg의 농도는 30.5 mass%에서 11.8 mass%와 5.72 mass%로 감소하였으며, 반응기 저온부에서 순도 99.993−99.999%의 Mg 금속을 회수하였다. 1300 K에서 진공증류 시 Mg−Ag 합금 내 Mg의 농도는 1.75 mass%로 감소하였으며, 반응기 저온부에서 순도 99.975%의 Mg 금속을 회수하였다. 실험결과로부터 1300 K에서 5시간 동안 Mg−Ag 합금을 진공증류 시 효율적으로 Mg을 회수할 수 있음을 알 수 있다.
또한, Mg−Sn 합금을 1200 K에서 5시간 진공증류 한 결과, 표 4와 같이 Mg−Sn 합금 내 Mg의 농도는 34.1 mass%에서 1.4 mass%로 감소했으며, 반응기 저온부에서 순도 99.998%의 Mg 금속을 회수하였다. 실험결과로부터 Mg−Sn 합금을 1200 K에서 5시간 진공증류 시 Mg을 효율적으로 회수할 수 있음을 알 수 있다. 이와 같은 결과로부터 Mg 합금의 진공증류에 필요한 공정에너지 및 Mg 회수율 고려 시 음극으로 Sn의 사용이 가장 바람직함을 알 수 있다.
5. 결 론본 연구에서는 MgO을 원료로 직접 사용하고, 액체금속 음극을 이용한 용융염 전해법인 MSE-LMC법을 개발하였다. MSE-LMC법을 이용한 Mg 금속 제조에 관한 실험을 실시하였으며 다음과 같은 결론을 얻을 수 있었다.
1) 1273 K의 MgF2−CaF2−NaF 용융염 및 1083−1093 K의 MgF2−LiF 용융염에서 Cu, Ag, 또는 Sn 음극 및 C 또는 Pt를 양극으로 사용하여 MgO의 전해를 수행한 결과, 음극의 종류에 따라 Cu2Mg, AgMg 또는 Mg2Sn 상을 가지는 Mg 합금이 형성되었으며, 본 논문의 실험 조건에서는 75.8% 이상의 전류효율을 나타냈다.
2) MgF2−CaF2−NaF 용융염 사용 시 Mg 합금 내 Mg함량이 9.1−14.6 mass%인 경우 전류효율은 75.8−85.6%였으며, MgF2−LiF 용융염 사용 시 Mg의 함량이 12.5−13.2 mass%인 경우 76.2−81.7%의 전류효율을 나타냈다.
3) Mg 합금 내 Mg 함량이 14.6 mass% 이하일 경우 1083−1273 K의 전해온도, 양극 소재는 전류효율에 큰 영향을 미치지 않았으나, 음극 소재에 따라 Mg 합금 내 Mg의 pMg의 영향 등에 의해 전류효율은 5.5-9.8%p의 차이를 나타냈다.
4) Mg−Cu, Mg−Ag, Mg−Sn 합금을 각각 1400 K, 1300 K, 1200 K에서 5시간 진공증류 시 Mg 합금 내 Mg의 농도는 30.2−34.1 mass%에서 0.64−1.75 mass%로 감소하였으며, 반응기 저온부에서 순도 99.975−99.999%의 Mg 금속을 회수하였다.
Acknowledgments본 연구는 2020년 정부(과학기술정보통신부)의 재원으로 국가과학 기술연구회 융합연구단 사업(No. CRC-15-06-KIGAM)의 지원을 받아 수행되었습니다.
Fig. 4.Binary phase diagrams of the (a) Mg – Cu, (b) Mg – Ag, and (c) Mg – Sn systems with the isobaric line of vapor pressure of Mg as a function of temperature and Mg concentration. 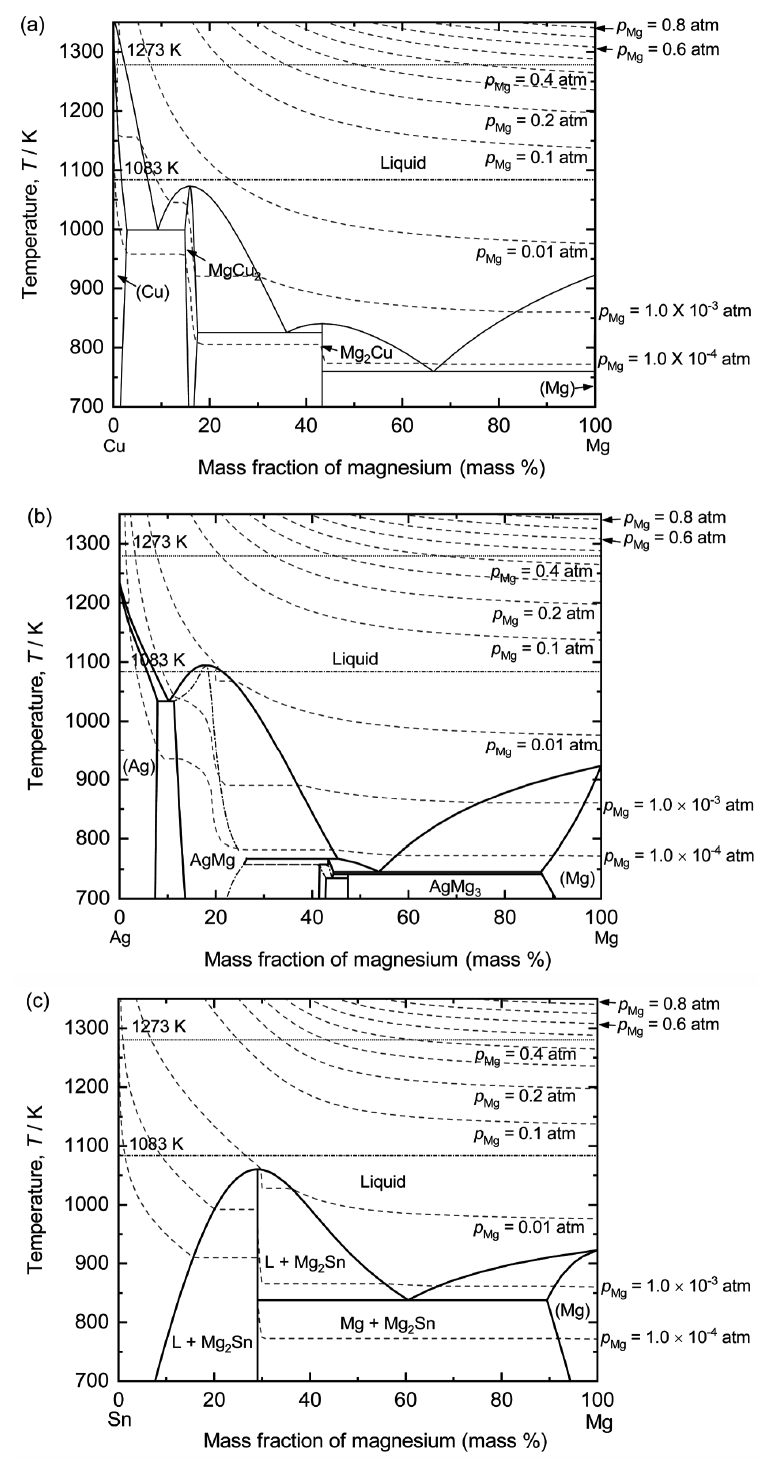
Fig. 6.Experimental apparatus for vacuum distillation: (a) schematic diagram; and (b) photograph of the cross-section of reactor. 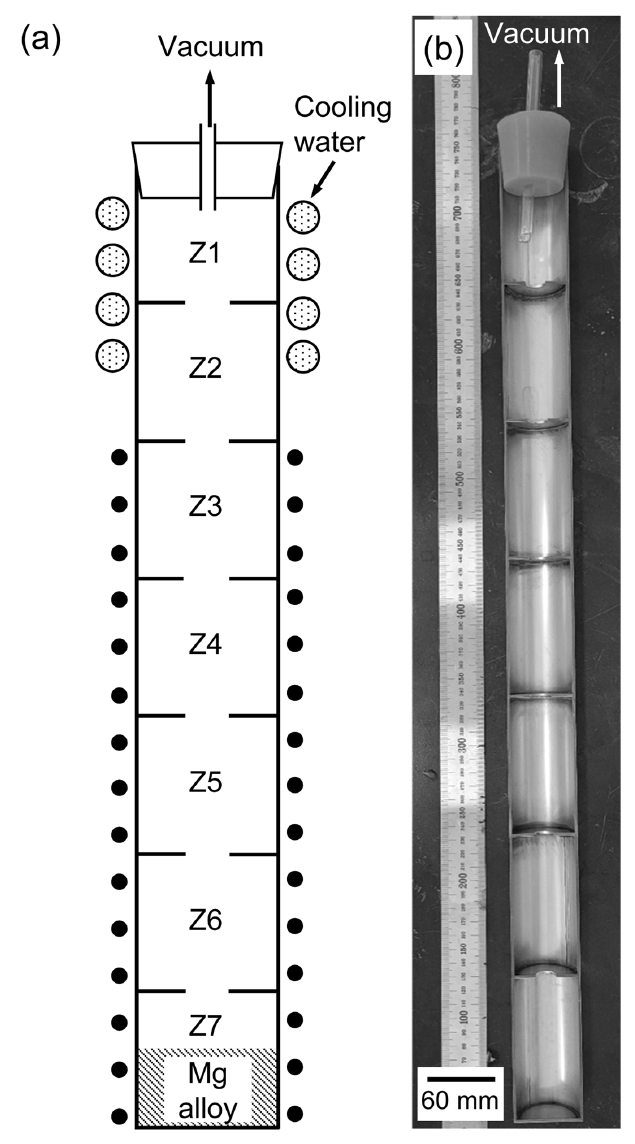
Fig. 7.Results of the XRD analysis of Mg alloys obtained after electrolysis of MgO in MgF2–CaF2–NaF molten salt at 1273 K using (a) Cu–Pt electrodes, (b) Cu–C electrodes, and (c) Sn–Pt electrodes. 
Fig. 8.Results of the SEM and EDS analysis of the cross-sections of Mg alloys obtained after electrolysis of MgO in MgF2–CaF2–NaF molten salt at 1273 K using (a) Cu–Pt electrodes, (b) Cu–C electrodes, and (c) Sn–Pt electrodes. 
Fig. 9.Results of the XRD analysis of Mg alloys obtained after electrolysis of MgO in MgF2–LiF molten salt using (a) Ag–C electrodes at 1083 K and (b) Cu–C electrodes at 1093 K. 
Fig. 10.Results of the XRD analysis of Mg alloys obtained after electrolysis of MgO in MgF2–LiF molten salt using (a) Ag–C electrodes at 1083 K and (b) Cu–C electrodes at 1093 K. 
Fig. 11.The temperature gradient of the reactor and photographs of Mg metals and the residues obtained after the vacuum distillation of Cu – Mg alloys at 1200 K for 5 h. 
Table 1.Theoretical decomposition voltages of selected fluorides and MgO at 1083 and 1273 K [23]. Table 2.Experimental conditions for the electrolysis of MgO using a liquid-metal cathode. a: Experimental conditions; 1) Quartz reactor was used in the experiments 2) MgO crucible was used for containing cathode metal except Exp. no. 180723 Al2O3 crucible was used for containing cathode metal for Exp. no. 180723 3) Applied cell voltage was 3.0 V. b: Wire: ϕ 1 mm (purity: 99.99%) c: Rod: ϕ 8 mm Table 3.Results of the electrolysis of MgO and analysis of Mg alloys obtained after electrolysis. a: Determined by inductively coupled plasma optical emission spectrometry (ICP-OES) analysis, N.D. : Not Detected (< 0.005 mass%). N.A. : Not Analyzed Other elements not in the table were not analyzed by ICP-OES b: Current efficiency (%) = (actual weight of Mg obtained × 100) / theoretical weight of Mg obtained Table 4.Experimental conditions and analytical results of the Mg metal obtained at the low-temperature part and the residue obtained at the bottom of the reactor after vacuum distillation.
a: Determined by glow discharge mass spectrometry (GD-MS) analysis; N.D.: Not Detected. Below the detection limit of the GD-MS (<0.001 ppm) All other elements were not detected by GD-MS analysis. b: The purity of magnesium was calculated by subtracting the sum of all impurities except chlorine. c: Determined by inductively coupled plasma optical emission spectrometry (ICP-OES) analysis, N.A.: Not Analyzed. REFERENCES3. U. H. Baek, B. D. Lee, K. W. Lee, G. S. Han, and J. W. Han, Korean J. Met. Mater. 54, 104 (2016).
4. U.S. Department of Energy, Materials Technologies: Goals, Strategies, and Top Accomplishments, https://www.enegy.gov/sites/prod/files/2014/03/f13/materials_tech_goals.pdf. (2010).
5. D. G. Lee, J. B. Kwon, H. J. Lee, S. M. Jo, Y. M. Rhyim, W. J. Yan, and Y. Kim, Korean J. Met. Mater. 57, 279 (2019).
6. Y. Wada, S. Fujii, E. Suzuki, M. M. Maitani, S. Tsubaki, S. Chonan, M. Fukui, and N. Inazu, Sci. Rep. 7, 46512 (2017).
7. L. M. Pidgeon and W. A. Alexander, Trans. Am. Inst. Min. Met. Eng. 159, 315 (1944).
9. H. E. Friedrich and B. L. Mordike, Magnesium Technology-Metallurgy, Design data, application, pp. 52–60, Springer, Berlin (2006).
12. G. J. Kipouros and D. R. Sadoway, Advanced Molten Salt Chemistry, pp. 127–209, Elsevier, Amsterdam (1987).
14. N. Leonard, M. Korenko, C. Larson, K. Blood, L. J. Venstrom, S. Nudehi, S. Duncan, R. Diver, F. Simko, J. Proscak, J. Schoer, P. T. Kissinger, and R. Palumbo, Chem. Eng. Sci. 148, 155 (2016).
15. X. Guan, U. B. Pal, and A. C. Powell, Metall. Mater. Trans. E. 1, 132 (2014).
17. A. C. Powell IV, Final Scientific/Technical Report of Industrial Scale-Up of Low-Cost Zero-Emission Magnesium by INFINIUM electrolysis. https://www.osti.gov.biblio/1431302. (2018).
18. T. H. Lee, T. H. Okabe, J. Y. Lee, Y. M. Kim, and J. Kang, Metall. Mater. Trans. B. 51, 2993 (2020).
19. T. H. Lee, T. H. Okabe, J. Y. Lee, Y. M. Kim, and J. Kang, J. Magnes. Alloy. (In press).
20. D. H. Lee, H. J. Jeoung, T. H. Lee, K. W. Yi, J. Y. Lee, Y. M. Kim, T. H. Okabe, and J. Kang, J. Sustain. Met. (In press).
23. I. Barin, Thermochemical Data of Pure Substances, 3rd ed. VCH Verlagsgesellschaft mbH, Weinheim (1995).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||