
|
| ļ¬®ņĀü ļ░Å ļ▓öņ£ä Aims and Scope |
| ņĀĆļäÉ ņĀĢļ│┤ About the Journal |
| ĒÄĖņ¦æņ£äņøÉĒÜī Editorial Board |
| Open Access |
| ĒÄĖņ¦æĻĄŁ Editorial Office |


|
| ļ¬®ņĀü ļ░Å ļ▓öņ£ä Aims and Scope |
| ņĀĆļäÉ ņĀĢļ│┤ About the Journal |
| ĒÄĖņ¦æņ£äņøÉĒÜī Editorial Board |
| Open Access |
| ĒÄĖņ¦æĻĄŁ Editorial Office |

AbstractBipolar electrodialysis was used in a process of desalting a lithium sulfate solution, converting it to lithium hydroxide and sulfuric acid, and concentrating and recovering them. The effects of the experimental variables such as applied voltage, the concentration of electrode solution, the concentration of raw material solution, volume ratio, and impurity were confirmed. The optimum conditions were investigated by comparing the conversion(%) of lithium hydroxide and sulfuric acid, the process time, and energy consumption. As the applied voltage was increased, the energy consumption tended to increase, but the processing time decreased significantly. As the concentration of lithium sulfate in the raw material solution increased, the conversion(%) of lithium hydroxide decreased. As the concentration of lithium sulfate increased, the energy consumption did not increase linearly, and energy consumption increased significantly. When a raw material solution of 0.5 M Li2SO4 or more is used in the bipolar electrodialysis process, an applied voltage of 25 V is preferable. As the applied voltage increased at a constant process time, the conversion(%) of LiOH and H2SO4 increased. Regarding the effect of the electrode solution concentration, when a 5.0 wt% electrode solution was used rather than a 3.0 wt% electrode solution, energy consumption decreased by more than 10%. When the volume of the raw material solution was increased, the processing time required for desalting increased. By using a low concentration raw material solution, it was confirmed that it was simultaneously possible to recover and concentrate lithium hydroxide and sulfuric acid through volume ratio control. When the raw material solution contained Na as an impurity, it was converted to NaOH with a surface LiOH, and it was not possible to separate the lithium and sodium.
1. ņä£ ļĪĀļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆļŖö ņŖżļ¦łĒŖĖĒÅ░, ļģĖĒŖĖļČü ļ░░Ēä░ļ”¼ ļō▒ IT ĻĖ░ĻĖ░ņŚÉ ņé¼ņÜ®ļÉśļŖö Ļ░£ļ│ä ņģĆ ļŗ©ņ£äņØś ļ░░Ēä░ļ”¼ņŚÉņä£ļČĆĒä░ ņĀäĻĖ░ņ×ÉļÅÖņ░©(EV; Electric Vehicle) ļ░Å ņĀäļĀźņĀĆņןņןņ╣ś(ESS; Energy Storage System)ņŚÉ ņé¼ņÜ®ļÉśļŖö ļīĆĒśĢ ļ¬©ļōłĒśĢ ļ░░Ēä░ļ”¼Ļ╣īņ¦Ć ņØæņÜ® ļČäņĢ╝Ļ░Ć ļŗżņ¢æĒĢ┤ņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░ ļ░░Ēä░ļ”¼ ņāØņé░ļ¤ēņØ┤ ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ņ”ØĻ░Ć ņČöņäĖņŚÉ ņ׳ļŗż [1]. ļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆņØś ņāØņé░ļ¤ē ņ”ØĻ░ĆņÖĆ ļŹöļČłņ¢┤ ļ░£ņāØļÉśļŖö ĒÅÉļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆņØś ļ░£ņāØļ¤ēļÅä ļ¦żļģä ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ņ¢┤, ņØ┤ļ¤¼ĒĢ£ ĒÅÉļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆļĪ£ļČĆĒä░ ņ£ĀĻ░Ć ĻĖłņåŹņØä ĒÜīņłśĒĢśņŚ¼ ņ×¼ĒÖ£ņÜ®ĒĢśļŖö ĻĖ░ņłĀņØ┤ ĒĢäņÜöĒĢśļŗż. ĻĖ░ņĪ┤ņŚÉļŖö ņŻ╝ļĪ£ ĒÅÉļ”¼ĒŖ¼ņĀäņ¦Ć ņ¢æĻĘ╣ĒÖ£ ļ¼╝ņ¦łņŚÉņä£ ņĮöļ░£ĒŖĖ, ļŗłņ╝ł ļō▒ņØś ņ£ĀĻ░Ć ĻĖłņåŹ ĒÜīņłśņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļŗżņłś ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż [2-3]. ĒÅÉļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆņŚÉņä£ ņ£ĀĻ░ĆĻĖłņåŹņØä ĒÜīņłśĒĢśļŖö Ļ│ĄņĀĢņØĆ ļ©╝ņĀĆ ļ”¼ĒŖ¼ņĀäņ¦Ć ņ¢æĻĘ╣ ĒÖ£ļ¼╝ņ¦łņØä ĒÖ®ņé░ņ£╝ļĪ£ ņ╣©ņČ£ĒĢ£ Ēøä ņÜ®ļ¦żņČöņČ£ļ▓ĢņŚÉ ņØśĒĢ┤ ņĮöļ░£ĒŖĖ ļ░Å ļŗłņ╝ł ņä▒ļČäņØä ĒÜīņłśĒĢśĻ│Ā ļéśļ®┤ ņĄ£ņóģņĀüņ£╝ļĪ£ ļ”¼ĒŖ¼ĒĢ©ņ£Ā ĒÅÉņĢĪ(Li2SO4)ņØ┤ ļ░£ņāØļÉ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ĒÅÉņĢĪ ņżæņŚÉļŖö ļ”¼ĒŖ¼ņØ┤ ņĢĮ 2.5~3.0 g/L ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ņ¢┤, ņŚ╝ĒśĖ(Brine)ņŚÉ ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ļŖö ļ”¼ĒŖ¼(ņĢĮ 0.3~1.0 g/L)ļ│┤ļŗż ļåŹļÅäĻ░Ć ļåÆņĢä ĒÜīņłśĒĢśņŚ¼ ņ×¼ņé¼ņÜ®ĒĢĀ ļ¦īĒĢ£ ņČ®ļČäĒĢ£ Ļ░Ćņ╣śĻ░Ć ņ׳ļŗż [4-7].
ņØ┤ļ¤¼ĒĢ£ ĒÅÉĒÖ®ņé░ļ”¼ĒŖ¼(Li2SO4)ņÜ®ņĢĪņŚÉņä£ ļ”¼ĒŖ¼ņØä ĒÜīņłśĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ļŖö ļČäļ│äĻ▓░ņĀĢļ▓ĢņØ┤ļéś, ņÜ®ļ¦żņČöņČ£ļ▓Ģ, ņØ┤ņś©ĻĄÉĒÖśņłśņ¦Ćļ▓Ģ, ņĀäĻĖ░Ēł¼ņäØļ▓Ģ ļō▒ņØ┤ ņ׳ņ£╝ļ®░ ņØ╝ļČĆ ņØĖņé░ļ”¼ĒŖ¼ ļśÉļŖö ĒÖ®ņé░ļ”¼ĒŖ¼ ļ░Å Ēāäņé░ļ”¼ĒŖ¼(Li2CO3) ĒśĢĒā£ļĪ£ ĒÜīņłśĒĢ£ Ēøä ĒøäņåŹĻ│ĄņĀĢņŚÉ ņØśĒĢ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼(LiOH)ĒśĢĒā£ļĪ£ ņĀ£ņĪ░ĒĢśņŚ¼ ņØ┤ņ░©ņĀäņ¦Ć ņøÉļŻīļĪ£ ņ×¼ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŗż [8-10]. ĻĘĖļ¤¼ļéś ņØ┤ļ¤¼ĒĢ£ ņØ╝ļĀ©ņØś ļŗ©ņ£äĻ│ĄņĀĢņØä Ļ▒░ņ│É ņłśņé░ĒÖöļ”¼ĒŖ¼ņØä ņĀ£ņĪ░ĒĢśļŖö Ļ▓ĮņÜ░ Ļ│ĄņĀĢņØ┤ ļ│Ąņ×ĪĒĢśĻ│Ā Ļ│ĄņĀĢ ļČĆņé░ļ¼╝ņØ┤ ļ░£ņāØĒĢśņŚ¼ ĒÅÉĻĖ░ļ¼╝ ņ▓śļ”¼ ļ░Å ĒÖśĻ▓ĮņśżņŚ╝ņØś ņøÉņØĖņØ┤ ļÉĀ ņłś ņ׳ņ¢┤ ļ│┤ļŗż ĒÖśĻ▓Į ņ╣£ĒÖöņĀüņØĖ ĒÜīņłś Ļ│ĄņĀĢ Ļ░£ļ░£ņØ┤ ņÜöĻĄ¼ļÉśĻ│Ā ņ׳ļŗż [11-12]. ņØ┤ņŚÉ ļīĆĒĢ£ ļīĆņĢłņ£╝ļĪ£ ņĀäĻĖ░Ēł¼ņäØ ļ░®ļ▓Ģ, ĒŖ╣Ē׳ ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØņןņ╣śļź╝ ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ņŚÉļŖö ĒÖ®ņé░ļ”¼ĒŖ¼ņÜ®ņĢĪņŚÉņä£ ļ░öļĪ£ ņĀĢņĀ£ļÉ£ ņłśņé░ĒÖöļ”¼ĒŖ¼ ņÜ®ņĢĪņ£╝ļĪ£ ĒÜīņłśĻ░Ć Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ│ĄņĀĢņØä ļŗ©ņł£ĒÖöĒĢĀ ņłś ņ׳ņ£╝ļ®░ ĒÖśĻ▓Į ņ╣£ĒÖöņĀüņØĖ ļ░®ļ▓Ģņ£╝ļĪ£ ņŻ╝ļ¬® ļ░øĻ│Ā ņ׳ļŗż. ņĀäĻĖ░Ēł¼ņäØļ▓ĢņØĆ ņØ┤ņś©ĻĄÉĒÖśļ¦ē(membrane)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņĀäĻĖ░ ņŚÉļäłņ¦Ćļ¦īņ£╝ļĪ£ ĒÖöĒĢÖļ¼╝ņ¦łņØä ļČäļ”¼ Ēś╣ņØĆ ļåŹņČĢ ņŗ£Ēé¼ ņłś ņ׳ņ¢┤ Ļ│ĄņĀĢ ņÜ┤ņĀä ņżæ ļČĆņé░ļ¼╝ņØ┤ ļ░£ņāØļÉśņ¦Ć ņĢŖĻ│Ā, ļ╣äĻĄÉņĀü ļé«ņØĆ ņŚÉļäłņ¦ĆļĪ£ ļīĆļ¤ē ņ▓śļ”¼Ļ░Ć Ļ░ĆļŖźĒĢśļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż [13-16].
ĻĘĖ ņżæņŚÉņä£ļÅä ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ(Electro Dialysis with Bipolar Membrane, EDBM) Ļ│ĄņĀĢņŚÉņä£ļŖö ņ¢æņØ┤ņś©ĻĄÉĒÖśņĖĄĻ│╝ ņØīņØ┤ņś©ĻĄÉĒÖśņĖĄņØ┤ Ļ▓░ĒĢ®ļÉ£ ĒśĢĒā£ņØĖ ļ░öņØ┤ĒÅ┤ļØ╝ ļ¦ēņØ┤ ņĀüņÜ®ļÉśļŖöļŹ░, ļ░öņØ┤ĒÅ┤ļØ╝ ļ¦ēņØĆ ņŚŁ ļ░öņØ┤ņ¢┤ņŖż(ļ░öņØ┤ĒÅ┤ļØ╝ ļ¦ēņØś ņ¢æņØ┤ņś© ĻĄÉĒÖśņĖĄņØ┤ ņØīĻĘ╣ņØä, ņØīņØ┤ņś© ĻĄÉĒÖśņĖĄņØ┤ ņ¢æĻĘ╣ņØä Ē¢źĒĢśĻ│Ā ņ׳ļŖö ņāüĒā£)ņĪ░Ļ▒┤ņŚÉņä£ ļ¼╝ ļČäņ×Éļź╝ ņłśņåī ņØ┤ņś©Ļ│╝ ņłśņé░ĒÖö ņØ┤ņś©ņ£╝ļĪ£ ļČäĒĢ┤ĒĢśļŖö ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņä▒ ļŹĢļČäņŚÉ EDBM Ļ│ĄņĀĢņŚÉņä£ ļŗżļźĖ ļČĆņé░ļ¼╝ņØś ļ░£ņāØ ņŚåņØ┤ ņé░┬ĘņŚ╝ĻĖ░ļź╝ ņāØņé░ ĒĢĀ ņłś ņ׳ņ¢┤, ņĀĆņśżņŚ╝ ļ¼┤Ļ│ĄĒĢ┤ Ļ│ĄņĀĢņ£╝ļĪ£ ņżæņÜöņä▒ņØ┤ ļīĆļæÉļÉśĻ│Ā ņ׳ļŗż [17]. ļ░öņØ┤ĒÅ┤ļØ╝ ļ¦ēņØĆ ļé«ņØĆ ņŚÉļäłņ¦ĆļĪ£ ļ╣Āļź┤Ļ▓ī ļ¼╝ņØä ļČäĒĢ┤ņŗ£ņ╝£ ņŚ╝ņØä ĒżĒĢ©ĒĢśĻ│Ā ņ׳ļŖö ĒÅÉņĢĪņŚÉņä£ ņé░Ļ│╝ ņŚ╝ĻĖ░ļź╝ ļČäĒĢ┤ĒĢśņŚ¼ ļ¼╝ņ¦łņØä ĒÜīņłś┬Ęņ×¼ņāØĒĢśļŖö Ļ│ĄņĀĢņŚÉ ņĀüņÜ®ĒĢśĻĖ░ ņ£äĒĢ┤ ĒÖ£ļ░£Ē׳ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż [18-21]. ĻĖ░ņĪ┤ņØś ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢņŚÉņä£ļŖö ļŗ©ņØ╝ ņØ┤ņś©ĻĄÉĒÖśļ¦ēņŚÉ ņØśĒĢ£ ņŚ╝ņØś ļČäļ”¼, ņŚ¼ļ¤¼ ņīŹņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņ¢æ┬ĘņØīņØ┤ņś© ĻĄÉĒÖśļ¦ēņ£╝ļĪ£ ņŚ╝ ļō▒ņØä ļåŹņČĢĒĢśļŖöļŹ░ ņŻ╝ļĪ£ ņé¼ņÜ®ļÉśņŚłņ£╝ļéś [22-23] Ļ│ĀĒÜ©ņ£© ļ░öņØ┤ĒÅ┤ļØ╝ ļ¦ēņØä ņé¼ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ĒÅÉņłś ļ░Å ņ£ĀĻĖ░, ļ¼┤ĻĖ░ņŚ╝ņØś ņ▓śļ”¼ ļō▒ņŚÉ ĻĘĖ ņĀüņÜ® ļ▓öņ£äĻ░Ć ĒÖĢļīĆļÉśĻ│Ā ņ׳ļŖö ņČöņäĖņØ┤ļŗż [17]. ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢņŚÉ ņØśĒĢ£ ĒÖ®ņé░ļ”¼ĒŖ¼ņÜ®ņĢĪņØś ĒāłņŚ╝ ļ░Å ņłśņé░ĒÖöļ”¼ĒŖ¼, ĒÖ®ņé░ņØś ņāØņä▒ņŚÉ ļīĆĒĢ£ ļ¬©ņŗØļÅäļź╝ ĻĘĖļ”╝ 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņøÉļŻīņÜ®ņĢĪņØä Ēł¼ņ×ģĒĢśļ®┤ ņ¢æ┬ĘņØīņØ┤ņś© ĻĄÉĒÖśļ¦ēņØä ĒåĄĒĢ┤ Ļ░üĻ░ü Li+Ļ│╝ SO42-ļĪ£ ļČäļ”¼ļÉśĻ│Ā, ļ░öņØ┤ĒÅ┤ļØ╝ ļ¦ē ņżæĻ░ä Ļ│äļ®┤ņŚÉņä£ļ¼╝ņØ┤ H+ņÖĆ OH-ļĪ£ ļ¦żņÜ░ ļ╣Āļź┤Ļ▓ī ĒĢ┤ļ”¼ļÉśņ¢┤ Ļ░ĢĒĢ£ ņĀäĻĖ░ņןņŚÉ ņØśĒĢ┤ ļ¦ē Ļ│äļ®┤ņŚÉņä£ ņŻ╝ļ│ĆņÜ®ņĢĪņ£╝ļĪ£ ņØ┤ļÅÖĒĢśņŚ¼ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ ņÜ®ņĢĪņ£╝ļĪ£ ĒÜīņłś ĒĢĀ ņłś ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØņØä ņé¼ņÜ®ĒĢśņŚ¼ ĒÖ®ņé░ļ”¼ĒŖ¼ ņøÉļŻī ņÜ®ņĢĪņØä ĒāłņŚ╝ĒĢśņŚ¼ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ ĒÜīņłśĒĢśĻ│Āņ×É ĒĢśņśĆĻ│Ā, ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅä, ņØĖĻ░ĆņĀäņĢĢ, ņĀäĻĘ╣ņĢĪņØś ļåŹļÅä, ļČłņł£ļ¼╝ ņśüĒ¢ź ļō▒ņØś Ļ│ĄņĀĢ ļ│ĆņłśņŚÉ ļīĆĒĢśņŚ¼ ĻĖ░ņ┤ł ņŗżĒŚśņØä ĒåĄĒĢ┤ Ļ│ĄņĀĢ Ļ░£ļ░£ņØś ĻĖ░ņ┤łļź╝ ļ¦łļĀ©ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
2. ņŗżĒŚś ņןņ╣ś ļ░Å ļ░®ļ▓Ģ2.1 ņŗżĒŚśņןņ╣śĒÖ®ņé░ļ”¼ĒŖ¼ ņÜ®ņĢĪņŚÉņä£ ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢņŚÉ ņØśĒĢ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼ņØäĒÜīņłśĒĢśĻĖ░ņ£äĒĢ┤ņé¼ņÜ®ĒĢ£ņŗżĒŚśņןņ╣śļĪ£ļŖö ACILYZER EX3B (Astom Co., Japan)ņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ņןņ╣śņØś ņé¼ņ¦ä ļ░Å ņé¼ņ¢æņØä ĻĘĖļ”╝ 2ņÖĆ Ēæ£ 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņןņ╣ś ļé┤ļČĆņŚÉļŖö ņĀĢļźśĻĖ░,ņĢĪ ĒÄīĒöäļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņĀäļ®┤ ņĀ£ņ¢┤ ņןņ╣śļź╝ ĒåĄĒĢ┤ ņÜ®ņĢĪ ĒÄīĒöä ņ×æļÅÖĻ│╝ ņŗżĒŚś ņĪ░Ļ▒┤ ļō▒ņØä ņĀ£ņ¢┤ ĒĢĀ ņłś ņ׳ļŗż. ņןņ╣ś ņÖĖļČĆņŚÉļŖö ņÜ®ņĢĪ Ēł¼ņ×ģ ņĢĪņŗż(tank)ņØ┤ ņ׳ņ£╝ļ®░, Ļ░üĻ░ü ņĀäĻĘ╣ņĢĪņŗż(Electrode sol. tank), ņŚ╝ĻĖ░ ĒÜīņłśņŗż(Basic sol. recovery tank), ņé░ ĒÜīņłśņŗż(Acidic sol. recovery tank), ņøÉļŻīņÜ®ņĢĪņŗż(Sample sol. tank)ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż. ņØ┤ņś©ĻĄÉĒÖś ņ╣┤ĒŖĖļ”¼ņ¦ĆļŖö 11ņןņØś ļ░öņØ┤ĒÅ┤ļØ╝ ļ®żļĖīļĀłņØĖĻ│╝ 10ņīŹņØś ņ¢æ/ņØīņØ┤ņś© ĻĄÉĒÖś ļ®żļĖīļĀłņØĖņ£╝ļĪ£ ĻĄ¼ņä▒ĒĢśņŚ¼ ņ╣┤ĒŖĖļ”¼ņ¦Ć ļé┤ ļ¦ē ņ£ĀĒÜ© ļ®┤ņĀü 550 cm2ņØ┤ļ®░, ļ░śņØæņØ┤ ņ¦äĒ¢ēļÉśļ®┤ ĒāłņŚ╝Ļ│╝ ļÅÖņŗ£ņŚÉ ņé░, ņŚ╝ĻĖ░ ņÜ®ņĢĪņØä ļČäļ”¼ĒĢśņŚ¼ ĒÜīņłś ĒĢĀ ņłś ņ׳ļŗż. ļ░öņØ┤ĒÅ┤ļØ╝ ļ░Å ņ¢æ/ņØīņØ┤ņś© ĻĄÉĒÖś ļ®żļĖīļĀłņØĖņØś ņŻ╝ņÜö ņé¼ņ¢æņØä Ēæ£ 2ņŚÉ ļéśĒāĆļé┤ņŚłĻ│Ā, ļ®żļĖīļĀłņØĖ ļ¬©ļæÉ Astomņé¼(Japan)ņØś ņĀ£ĒÆłņØä ņé¼ņÜ®ĒĢśņśĆļŗż.
2.2 ņŗżĒŚśļ░®ļ▓ĢņĀäĻĘ╣ņĢĪ(Electrode sol.)ņ£╝ļĪ£ļŖö 4.0 wt% ņłśņé░ĒÖöļéśĒŖĖļź© ņłśņÜ®ņĢĪ 500 mLņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņøÉļŻīņÜ®ņĢĪ(Sample sol.)ņ£╝ļĪ£ļŖö 0.1 M ĒÖ®ņé░ļ”¼ĒŖ¼ ņłśņÜ®ņĢĪ ĻĘĖļ”¼Ļ│Ā ņ┤łĻĖ░ ņé░ ĒÜīņłśņŗżĻ│╝ ņŚ╝ĻĖ░ ĒÜīņłśņŗżņŚÉļŖö ņ”Øļźśņłśļź╝ ņןņ×ģĒĢśņŚ¼ ĒÖ®ņé░ļ”¼ĒŖ¼ ņÜ®ņĢĪņØś ĒāłņŚ╝ņØä ĒåĄĒĢ┤ Ļ░üĻ░ü ĒÖ®ņé░Ļ│╝ ņłśņé░ĒÖöļ”¼ĒŖ¼ņ£╝ļĪ£ ĒÜīņłśĒĢśņśĆļŗż. ņĀäĻĘ╣ņĢĪ ņĀ£ņĪ░ņŚÉļŖö 40 wt% ņłśņé░ĒÖöļéśĒŖĖļź©(40% Sodium hydroxide solution, DAEJUNG)ņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņøÉļŻī ņÜ®ņĢĪ ņĀ£ņĪ░ļź╝ ņ£äĒĢ┤ ĒÖ®ņé░ļ”¼ĒŖ¼(Lithium sulfate monohydrate, 99%, JUNSEI), ĒÖ®ņé░ļéśĒŖĖļź©(Sodium sulfate, 99%, DAEJUNG) ļō▒ņØś ņŗ£ņĢĮņØä ņé¼ņÜ®ĒĢśņśĆļŗż. Ļ░ü ņŗżĒŚśņŚÉ ļ¦×ņČ░ ņÜ®ņĢĪņØś ņĪ░ņä▒ ļ░Å ņŗżĒŚś ņĪ░Ļ▒┤ņØä ļ│ĆĻ▓ĮĒĢśņŚ¼ ņØĖĻ░ĆņĀäņĢĢ, ņĀäĻĘ╣ņĢĪņØś ļåŹļÅä, ņ┤łĻĖ░ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅä, ļČĆĒö╝ļ╣äņÖĆ ļČłņł£ļ¼╝ņØś ņśüĒ¢źņØä ņé┤ĒÄ┤ļ│┤ņĢśļŗż. Ļ│ĄņĀĢ ņżæ ņøÉļŻī ņÜ®ņĢĪņØś ņĀäĻĖ░ņĀäļÅäļÅä Ļ░ÉņåīļĪ£ ņØĖĒĢ£ ņĀäņĢĢ ņ”ØĻ░ĆļĪ£ ņØĖĒĢ£ ļ¦ē ņåÉņāüņØä ņÜ░ļĀżĒĢśņŚ¼ ņĀĢņĀäņĢĢ ņĪ░Ļ▒┤ņŚÉņä£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ļČĆĒö╝ļ╣äļŖö S/A/BļĪ£ ļéśĒāĆļé┤ņŚłņ£╝ļ®░ Ļ░üĻ░ü ņøÉļŻīņÜ®ņĢĪņŗż(S), ņé░ ĒÜīņłśņŗż(A)Ļ│╝ ņŚ╝ĻĖ░ ĒÜīņłśņŗż(B)ņŚÉ ņ┤łĻĖ░ ņןņ×ģļÉśļŖö ņÜ®ņĢĪņØś ļČĆĒö╝ļź╝ ņØśļ»ĖĒĢ£ļŗż. ņ┤łĻĖ░ ņÜ®ņĢĪ Ēł¼ņ×ģ Ēøä ņĢĪ ĒÄīĒöäļź╝ 5ļČäĻ░ä ņ×æļÅÖņŗ£ņ╝£ ļ®żļĖīļĀłņØĖ ņ╣┤ĒŖĖļ”¼ņ¦ĆņÖĆ ĒŖ£ļĖī ļé┤ ņ×öņĪ┤ĒĢśļŖö Ļ│ĄĻĖ░ļź╝ ņĀ£Ļ▒░ĒĢ£ ĒøäņŚÉ ņĀäņĢĢņØä ņØĖĻ░ĆĒĢśņśĆļŗż. ļ░śņØæņØĆ ņøÉļŻīņÜ®ņĢĪņØś ņĀäĻĖ░ņĀäļÅäļÅäĻ░Ć 2.0 mS/cm(SļŖö ņĀäļÅäļÅäņØś ļŗ©ņ£äļĪ£ ņĀäĻĖ░ņĀĆĒĢŁņØś ļŗ©ņ£ä ņś┤(Ōä”)ņØś ņŚŁņłśņØ┤ļ®░ 1 S = 1 A/V = 1/Ōä”) ņØ┤ĒĢśĻ░Ć ļÉĀ ļĢī ņóģļŻīĒĢśņśĆņ£╝ļ®░, ņŗżĒŚś ņóģļŻī Ēøä ņĀ£ņ¢┤ ņןņ╣śļź╝ ĒåĄĒĢ┤ Ļ░ü ņÜ®ņĢĪņØś ņĄ£ņóģ ņĀäļźś ļ░Å ņĀäĻĖ░ļ¤ēĻ│╝ Ļ│ĄņĀĢ ņåīņÜö ņŗ£Ļ░äņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļ░śņØæ Ēøä ņāśĒöīņØä ņ▒äņĘ©ĒĢśņŚ¼ ņøÉļŻīņÜ®ņĢĪņØś ĒāłņŚ╝ ņŚ¼ļČĆņÖĆ ĒÜīņłśļÉ£ ņłśņé░ĒÖöļ”¼ĒŖ¼ņØś ļåŹļÅäļź╝ ICPAES(Perkin Elmer/Optima-4300 DV)ļĪ£ ļČäņäØĒĢśņśĆĻ│Ā, ĒÜīņłśļÉ£ ĒÖ®ņé░ ņÜ®ņĢĪņØĆ ņżæĒÖöņĀüņĀĢņØä ĒåĄĒĢ┤ ļåŹļÅäļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. ICP ļČäņäØĻ│╝ ņżæĒÖö ņĀüņĀĢņØä ĒåĄĒĢ┤ ņ¢╗ņØĆ Ļ▓░Ļ│╝ Ļ░ÆņØä ĒåĄĒĢ┤ Li+ņØś ļåŹļÅäņÖĆ SO42-ņØś ļåŹļÅäļź╝ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņŗØ (1) ļ░Å (2)ņŚÉ ņĀüņÜ®ĒĢśņŚ¼ ņĀäĒÖśņ£©(C, conversion, %)ņØä Ļ│äņé░ĒĢśņśĆļŗż.
(2)ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ē(E, energy consumption, kWh/m3)ņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņŗØ (3)ņ£╝ļĪ£ ĻĄ¼ĒĢśņśĆļŗż.
ņŚ¼ĻĖ░ņä£ U(V)ļŖö ņØĖĻ░ĆņĀäņĢĢ, I(A)ļŖö ĒÅēĻĘĀ ņĀäļźś, V(m3)ņØĆ ņøÉļŻīņÜ®ņĢĪņŗż, ņé░ ĒÜīņłśņŗż, ņŚ╝ĻĖ░ ĒÜīņłśņŗżņŚÉ Ēł¼ņ×ģ ļÉ£ ņÜ®ņĢĪ ļČĆĒö╝ņØś ņ┤ØĒĢ®ņØ┤Ļ│Ā, t(hr)ļŖö Ļ│ĄņĀĢ ņåīņÜö ņŗ£Ļ░äņØ┤ļŗż.
3. ņŗżĒŚś Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░3.1 ņØĖĻ░ĆņĀäņĢĢ ņśüĒ¢źņĀĢņĀäņĢĢ ņĪ░Ļ▒┤ņŚÉņä£ ņØĖĻ░ĆņĀäņĢĢņØä ļ│ĆĒÖöņŗ£Ēéżļ®┤ņä£ ņøÉļŻīņĢĪņØĖ ĒÖ®ņé░ļ”¼ĒŖ¼ņÜ®ņĢĪņŚÉņä£ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ņØś ņĀäĒÖśņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä Ļ│Āņ░░ĒĢśĻ│Āņ×É ņøÉļŻīņĢĪņŗżņŚÉ 0.1 M ĒÖ®ņé░ļ”¼ĒŖ¼ ņłśņÜ®ņĢĪĻ│╝ ņé░ ĒÜīņłśņŗż ļ░Å ņŚ╝ĻĖ░ ĒÜīņłśņŗżņŚÉ ņ”Øļźśņłśļź╝ Ļ░üĻ░ü 500 mLņö® Ēł¼ņ×ģĒĢśĻ│Ā(S/A/B=1/1/1), ņØĖĻ░ĆņĀäņĢĢ 13~30 V ņĪ░Ļ▒┤ņ£╝ļĪ£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ņŗØ(1) ļ░Å (2)ņŚÉ ņØśĒĢ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ņØś ņĀäĒÖśņ£©ņØä Ļ│äņé░ĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 3ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼ņØś Ļ▓ĮņÜ░ļŖö ņĢĮ 80%ņØś ņĀäĒÖśņ£©, ĒÖ®ņé░ņØĆ ņĢĮ 78%ņØś ņĀäĒÖśņ£©ņØä ļ│┤ņśĆļŗż. ņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØĆ Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļ®░, ĒÜīņłśļÉ£ ĒÖ®ņé░ņÜ®ņĢĪņØä ņĀüņĀĢļ▓Ģņ£╝ļĪ£ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ 0.078 M H2SO4ļĪ£ ĒÖĢņØĖĒĢśņśĆļŗż. ņłśņé░ĒÖöļ”¼ĒŖ¼ ņĀäĒÖśņ£©ņØś Ļ▓ĮņÜ░ļŖö ņØĖĻ░ĆņĀäņĢĢ ņ”ØĻ░Ć ņŗ£ ļé«ņØĆ ņĀäņĢĢņŚÉņä£ 82~83%ņØś ņĀäĒÖśņ£©ņØä ļ│┤ņśĆņ£╝ļéś, 30 VņŚÉņä£ļŖö 67%ļĪ£ ļŗżņåī Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłļŗż. Ēæ£ 3ņŚÉļŖö ĒÅēĻĘĀ ņĀäļźś, Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äĻ│╝ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØä ļéśĒāĆļé┤ņŚłļŗż. ņØĖĻ░ĆņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒÅēĻĘĀ ņĀäļźśļŖö ņ”ØĻ░ĆĒĢśņŚ¼ Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äņØä ļŗ©ņČĢņŗ£Ēé¼ ņłś ņ׳ņŚłļŖöļŹ░, ņØĖĻ░ĆņĀäņĢĢ 13 VņŚÉņä£ļŖö 102ļČäņØś ņŗ£Ļ░äņØ┤ ņåīņÜöļÉ£ ļ░śļ®┤, 25 V ņĪ░Ļ▒┤ņŚÉņä£ļŖö 26ļČäņ£╝ļĪ£ Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äņØä ņĢĮ 1/4ļĪ£ Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ņŚłļŗż. ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØĆ 13~20 V ņĪ░Ļ▒┤ņŚÉņä£ļŖö ĒÅēĻĘĀ 4.23 kWh/m3ņØ┤ņŚłņ£╝ļéś, 25 VņŚÉņä£ļŖö 5.33 kWh/m3ņ£╝ļĪ£ 30 VņŚÉņä£ļŖö 6.00 kWh/m3ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. 20 VņØ┤ņāüņŚÉņä£ļŖö Ļ│ĄņĀĢ ņåīņÜö ņŗ£Ļ░äņØś Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ Ļ│ĄņĀĢ ņŗ£Ļ░äĻ│╝ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØä Ļ│ĀļĀżĒĢśņśĆņØä Ļ▓ĮņÜ░ ņØĖĻ░ĆņĀäņĢĢņØä 20 VļĪ£ ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØ┤ ņĀüņĀłĒĢśļŗż.
3.2 ņøÉļŻīņÜ®ņĢĪ(ĒÖ®ņé░ļ”¼ĒŖ¼) ļåŹļÅäņśüĒ¢źņ┤łĻĖ░ ņøÉļŻī ņÜ®ņĢĪ ņżæ ĒÖ®ņé░ļ”¼ĒŖ¼ ļåŹļÅäņŚÉ ļö░ļźĖ ņśüĒ¢źņØä Ļ│Āņ░░ĒĢśĻĖ░ ņ£äĒĢ┤ ņøÉļŻī ņÜ®ņĢĪņØä 0.1~0.5 M Li2SO4ļź╝ ņé¼ņÜ®ĒĢśĻ│Ā ņĀĢņĀäņĢĢņØä 15, 20, 25, 30 Vļź╝ Ļ░üĻ░ü ņØĖĻ░ĆĒĢśņŚ¼, ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäņÖĆ ņØĖĻ░ĆņĀäņĢĢņØś ņśüĒ¢źņØä ļÅÖņŗ£ņŚÉ ĒÖĢņØĖĒĢśņśĆļŗż. ĻĘĖļ”╝ 4ņŚÉ ņ┤łĻĖ░ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäņÖĆ ņØĖĻ░ĆņĀäņĢĢņŚÉ ļö░ļźĖ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØä ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 4(a)ņŚÉņä£ 0.1 M Li2SO4ļź╝ ņøÉļŻī ņÜ®ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ņØĖĻ░ĆņĀäņĢĢ 15 VņŚÉņä£ ņłśņé░ĒÖöļ”¼ĒŖ¼ņØś ņĀäĒÖśņ£©ņØ┤ Ļ░Ćņן ļåÆņĢśņ£╝ļéś, ņØĖĻ░ĆņĀäņĢĢņØä 30 VļĪ£ ņ”ØĻ░Ćņŗ£Ēé¼ Ļ▓ĮņÜ░ņŚÉļŖö 1.0 M Li2SO4ļź╝ ņøÉļŻī ņÜ®ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ņłśņé░ĒÖöļ”¼ĒŖ¼ņ£╝ļĪ£ņØś ņĀäĒÖśņ£©ņØ┤ ļåÆņĢśļŗż. ņ┤łĻĖ░ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ņłśņé░ĒÖöļ”¼ĒŖ¼ņØś ņĀäĒÖśņ£©ņØ┤ ņåīĒÅŁ Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņØ┤ļŖöļŹ░, ņØ┤Ļ▓āņØĆ ņŚ╝ĻĖ░ ĒÜīņłśņŗż ļé┤ņŚÉ ņłśņé░ĒÖöļ”¼ĒŖ¼ņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņØ╝ļČĆ Li+ ņÖĆ OH- ņØ┤ņś©ņØ┤ ĒÖĢņé░ņŚÉ ņØśĒĢ┤ ņØ┤ņś©ĻĄÉĒÖśļ¦ēņØä Ēł¼Ļ│╝ĒĢśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ”╝ 4(b)ņŚÉļŖö ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØä ļéśĒāĆļé┤ņŚłļŖöļŹ░, ņ┤łĻĖ░ ĒÖ®ņé░ļ”¼ĒŖ¼ņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņĀäĒÖśņ£©ņØ┤ ņ”ØĻ░ĆĒĢśļŗżĻ░Ć ļŗżņŗ£ Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£© ļ¬©ļæÉ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ│ĄņĀĢ ņżæ ĒÜīņłśļÉśļŖö ņé░ Ēś╣ņØĆ ņŚ╝ĻĖ░ņØś ļåŹļÅä ņŚŁņŗ£ ņ”ØĻ░ĆĒĢśļŖöļŹ░ ņØ┤ļĢī 0.4 M Li2SO4 ņØ┤ņāüņØś ņøÉļŻī ņÜ®ņĢĪņØä ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░, ļåŹļÅä ņ░©ņŚÉ ņØśĒĢ£ ĒÖĢņé░ ņśüĒ¢źņØ┤ ņÜ░ņäĖĒĢśņŚ¼ ņĀäĒÖśņ£©ņØ┤ Ļ░ÉņåīĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ĒŖ╣Ē׳, ņłśņåī ņØ┤ņś©ņØś Ļ▓ĮņÜ░ ļ¦żņÜ░ Ēü░ ionic mobilityļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳Ļ│Ā, Grotthus mechanismņŚÉ ņØśĒĢ┤ ļ¼╝ ļČäņ×Éļź╝ ļ¦żĻ░£ļĪ£ ņēĮĻ▓ī ņØīņØ┤ņś© ĻĄÉĒÖśļ¦ēņØä Ēł¼Ļ│╝ĒĢśņŚ¼ [24], ĒÜīņłśļÉ£ ĒÖ®ņé░ņØś ļåŹļÅäĻ░Ć Ļ░ÉņåīĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņĀäĻĖ░ņĀü ņżæņä▒ ņ£Āņ¦Ćļź╝ ņ£äĒĢ┤ ĒÜīņłśļÉśļŖö ņłśņé░ĒÖöļ”¼ĒŖ¼ņØś ļåŹļÅäĻ░Ć ņŚŁņŗ£ Ļ░ÉņåīĒĢĀ ņłś ņ׳ļŗż. Ēæ£ 4ņŚÉļŖö ĒÅēĻĘĀ ņĀäļźś, Ļ│ĄņĀĢ ņŗ£Ļ░ä, ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØä ļéśĒāĆļé┤ņŚłņ£╝ļ®░, ņØĖĻ░ĆņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā, ņ┤łĻĖ░ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ĒÅēĻĘĀ ņĀäļźś Ļ░ÆņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗż. ļÅÖņØ╝ĒĢ£ ņØĖĻ░ĆņĀäņĢĢņŚÉņä£ ņ┤łĻĖ░ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ Ļ│ĄņĀĢ ņŗ£Ļ░äņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā, ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ē ņŚŁņŗ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ĻĘĖļ”╝ 5ņŚÉļŖö ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäņÖĆ ņäĀĒśĢņĀüņØĖ ļ╣äļĪĆ Ļ┤ĆĻ│äļĪ£ ņ”ØĻ░ĆĒĢ£ļŗżļŖö Ļ░ĆņĀĢ ĒĢśņŚÉ ņŗżņĀ£ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēĻ│╝ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ņøÉļŻī ņÜ®ņĢĪņØś ņ┤łĻĖ░ ļåŹļÅäĻ░Ć 2ļ░░ ņ”ØĻ░ĆĒĢĀ Ļ▓ĮņÜ░ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØĆ 2ļ░░ ņØ┤ņāüņØś ņ”ØĻ░Ć Ļ▓ĮĒ¢źņØä ļ│┤ņśĆņ£╝ļ®░, ņØ┤ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ ņØĖĻ░ĆņĀäņĢĢņØĖ 15 V ņĪ░Ļ▒┤ņŚÉņä£ ļŹö Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ĒĢ£ĒÄĖ, ņØĖĻ░ĆņĀäņĢĢ 30 V ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļåŹļÅäņØś ņ”ØĻ░ĆņÖĆ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ļ╣äļĪĆĒĢ┤ņä£ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłļŗż. ņ┤łĻĖ░ ĒÖ®ņé░ļ”¼ĒŖ¼ņØś ļåŹļÅäņÖĆ ņØĖĻ░ĆņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņäĀĒśĢņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņ¦Ć ņĢŖĻ│Ā ļŹö Ēü░ ņāüņŖ╣ĒÅŁņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż.
3.3 Ļ│ĄņĀĢ ņŗ£Ļ░ä ņśüĒ¢źļÅÖņØ╝ĒĢ£ ņØĖĻ░ĆņĀäņĢĢņŚÉņä£ Ļ│ĄņĀĢ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ Ļ░üĻ░ü ņØĖĻ░ĆņĀäņĢĢ 15, 20, 25, 30 V ņĪ░Ļ▒┤ņŚÉņä£ ņŗżĒŚśĒĢśņśĆļŗż. 0.2 M Li2SO4 ņÜ®ņĢĪņØä ņé¼ņÜ®ĒĢśņŚ¼ 5~60ļČä ņé¼ņØ┤ ļ▓öņ£äņŚÉņä£ ņØ╝ņĀĢĒĢśĻ▓ī ņāśĒöīļ¦üĒĢśņŚ¼ ņĀäĒÖśņ£©ņØä Ļ│äņé░ĒĢśņśĆņ£╝ļ®░, ĻĘĖļ”╝ 6ņŚÉ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 6(a), (b)ņŚÉņä£ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ ļ¬©ļæÉ ņØĖĻ░ĆņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ│ĄņĀĢ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ņĀäĒÖśņ£©ņØ┤ ĻĖēĻ▓®ĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. ĻĘĖļ”╝ 6(a)ņŚÉņä£ ļ│┤ļ®┤ ļ░śņØæ ņŗ£Ļ░ä 20ļČäņŚÉņä£ 20 V ņØ┤ĒĢśņØś ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņłśņé░ĒÖöļ”¼ĒŖ¼ņØ┤ 23% ļ»Ėļ¦īņØś ņĀäĒÖśņ£©ņØä ļ│┤ņśĆņ£╝ļéś, 25 V ņØ┤ņāüņŚÉņä£ļŖö 55% ņØ┤ņāüņØś ņĀäĒÖśņ£©ņØä ļ│┤ņśĆļŗż. ļśÉĒĢ£, ĻĘĖļ”╝ 6(b)ņŚÉņä£ļÅä ĒÖ®ņé░ņØĆ 20 V ņØ┤ĒĢśņŚÉņä£ 23% ļ»Ėļ¦īņØś ņĀäĒÖśņ£©ņØä ļ│┤ņśĆĻ│Ā, 25 V ņØ┤ņāüņŚÉņä£ 62% ņØ┤ņāüņØś ņĀäĒÖśņ£©ņØä ļ│┤ņŚ¼ ņØĖĻ░ĆņĀäņĢĢņØ┤ Ļ│ĄņĀĢ ņŗ£Ļ░ä Ļ░ÉņåīņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ Ēü¼ļŗżļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ĒĢ£ĒÄĖ, ņĢ×ņäĀ ņøÉļŻīņÜ®ņĢĪ(ĒÖ®ņé░ļ”¼ĒŖ¼) ļåŹļÅäņØś ņśüĒ¢ź ņŗżĒŚśņŚÉņä£ ņøÉļŻī ņÜ®ņĢĪņØś ņ┤łĻĖ░ ļåŹļÅäņÖĆ ņØĖĻ░ĆņĀäņĢĢņŚÉ ļö░ļźĖ Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äņØä ļéśĒāĆļé┤ņŚłļŖöļŹ░, ņØĖĻ░ĆņĀäņĢĢ ņ”ØĻ░Ć ņŗ£ Ļ│ĄņĀĢ ņåīņÜö ņŗ£Ļ░äņØ┤ Ļ░ÉņåīĒĢśņ¦Ćļ¦ī, ĒÅēĻĘĀ ņĀäļźśņØś ņ”ØĻ░ĆļĪ£ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØĆ ņ”ØĻ░ĆĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅäņŚÉ ļö░ļØ╝ ņØĖĻ░ĆņĀäņĢĢ, Ļ│ĄņĀĢ ņŗ£Ļ░ä, ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØä ļ¬©ļæÉ Ļ│ĀļĀżĒĢśņŚ¼ Ļ│ĄņĀĢņØä ņäżĻ│äĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗż.
3.4 ņĀäĻĘ╣ņĢĪ ļåŹļÅä ņśüĒ¢źņĀäĻĘ╣ņĢĪņØś ļåŹļÅäĻ░Ć Ļ│ĄņĀĢņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņé┤ĒÄ┤ļ│┤ĻĖ░ ņ£äĒĢ┤ ņØĖĻ░ĆņĀäņĢĢ 15 V ņĪ░Ļ▒┤ĒĢśņŚÉņä£ ņŗżĒŚśĒĢśņśĆņ£╝ļ®░, ņŗżĒŚś ņןņ╣śņØś ņĀäĻĘ╣ņĢĪ ņé¼ņÜ® ļåŹļÅä ņāüĒĢ£ņäĀņØĆ 4 wt%ņØ┤ļéś ņŗżĒŚśņØä ņ£äĒĢ┤ 3~5 wt% ņłśņé░ĒÖöļéśĒŖĖļź©(NaOH) ņłśņÜ®ņĢĪņØä ņĀäĻĘ╣ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż. ņØ┤ņŚÉ ļīĆĒĢ£ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ņØś ņĀäĒÖśņ£©ņØä ĻĘĖļ”╝ 7ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ņ£╝ļĪ£ļČĆĒä░ ņĢī ņłś ņ׳ļō»ņØ┤ ņĀäĻĘ╣ņĢĪņØś ļåŹļÅäĻ░Ć ņĀäĒÖśņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ»Ėļ»ĖĒĢśņśĆļŗż. Ēæ£ 5ņŚÉņä£ ņĀäĻĘ╣ņĢĪ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņĀäĻĖ░ņĀĆĒĢŁņØ┤ Ļ░ÉņåīĒĢśņŚ¼ ĒÅēĻĘĀ ņĀäļźśĻ░Ć ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ņØ┤ņŚÉ ļö░ļØ╝ Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äļÅä Ļ░ÉņåīĒĢśņśĆļŗż. ļÅÖņØ╝ĒĢ£ ņØĖĻ░ĆņĀäņĢĢņŚÉņä£ļŖö ņĀäĻĘ╣ņĢĪ ļåŹļÅäļź╝ ņ”ØĻ░ĆĒĢĀ Ļ▓ĮņÜ░ Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äņØĆ Ēü¼Ļ▓ī Ļ░ÉņåīĒĢ£ ļ░śļ®┤ņŚÉ ĒÅēĻĘĀ ņĀäļźśļŖö ņ”ØĻ░ĆĻ░Ć Ēü¼ņ¦Ć ņĢŖņĢä ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØĆ Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłļŗż. ļö░ļØ╝ņä£ ņĀäĻĘ╣ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ ņłśņé░ĒÖöļéśĒŖĖļź© ņÜ®ņĢĪņØś ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£Ēé¼ Ļ▓ĮņÜ░ ņĀäĒÖśņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ»Ėļ»ĖĒĢśļéś, 3 wt% NaOHļź╝ ņé¼ņÜ®ĒĢśļŖö Ļ▓āļ│┤ļŗż 5 wt% NaOHļź╝ ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØä 10%ņĀĢļÅä ņżäņØ╝ ņłś ņ׳ņ¢┤ ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ ņé¼ļŻīļÉ£ļŗż.
3.5 ļČĆĒö╝ļ╣ä ņśüĒ¢źņØ╝ļ░śņĀüņØĖ ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢņŚÉņä£ļŖö Ļ│ĀļČĆĒö╝ļ╣ä ļåŹņČĢ(High Volume Ratio Concentration, HVRC)Ļ│╝ ļŗżļŗ©ļåŹņČĢ(Multi Stage Concentration, MSC) ļ░®ņŗØņØä ņé¼ņÜ®ĒĢśņŚ¼ ļ¬®ņĀü ņä▒ļČäņØä ļåŹņČĢņŗ£Ēé¼ ņłś ņ׳ļŗż [22-23]. ĻĘĖļ¤¼ļéś ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ ļ░®ņŗØņŚÉņä£ļŖö ņøÉļŻī ņÜ®ņĢĪņØ┤ ļŗżļźĖ ņä▒ļČäņ£╝ļĪ£ ņĀäĒÖśļÉśņ¢┤ ĒÜīņłśļÉśĻĖ░ ļĢīļ¼ĖņŚÉ MSC ļ░®ņŗØņŚÉ ņØśĒĢ┤ņä£ ņøÉļŻī ņä▒ļČäņØä ļåŹņČĢĒĢśņŚ¼ ĒÜīņłśĒĢĀ ņłśļŖö ņŚåļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņøÉļŻīņÜ®ņĢĪĻ│╝ ņ┤łĻĖ░ ņé░ ĒÜīņłśņŗżĻ│╝ ņŚ╝ĻĖ░ ĒÜīņłśņŗżņŚÉ ņןņ×ģļÉśļŖö ņÜ®ņĢĪņØś ļČĆĒö╝ ņ░©ņØ┤ļź╝ ņØ┤ņÜ®ĒĢ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØä ļåŹņČĢĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ĒĢ£ EX3B ņןļ╣äļŖö Ēæ£ 1ņŚÉ ļéśĒāĆļéĖ Ļ▓āĻ│╝ Ļ░ÖņØ┤ Ļ░üĻ░üņØś Ļ│ĄņĀĢ ļØ╝ņØĖņŚÉ ļōżņ¢┤Ļ░ĆļŖö ņĢĪņØś ņÜ®ļ¤ēņØĆ ņĢĮ 150 mL ņĀĢļÅäņØ┤ļŗż. ļö░ļØ╝ņä£ Ļ│ĄņĀĢ ļØ╝ņØĖņŚÉ Ļ│ĄĻĖ░Ļ░Ć Ēś╝ņ×ģļÉśņ¢┤ ņĢĪ ņł£ĒÖś ļ░®ĒĢ┤ Ēś╣ņØĆ ļ¦┤ļĖīļĀłņØĖ ņé¼ņØ┤ņŚÉ Ļ│ĄĻĖ░ Ēś╝ņ×ģņŚÉ ņØśĒĢ£ ļČäĻĘ╣ ĒśäņāüņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö 300 mL ņØ┤ņāüņØś ņĢĪņØä Ēł¼ņ×ģĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ĻĖ░ņżĆ ļČĆĒö╝ 1ņØä 300 mLļĪ£ ĒĢśĻ│Ā, S/A/BņØś ļ╣äļź╝ 1/1/1, 2/1/1, 3/1/1ļĪ£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ļśÉĒĢ£ ņé¼ņÜ®ļÉ£ ņןļ╣ä ļé┤ņŚÉņä£ Ļ░Ćņן ļåÆņØĆ ļČĆĒö╝ļ╣äļĪ£ ņŗżĒŚśĒĢśĻĖ░ ņ£äĒĢ┤ ĻĖ░ņżĆ ļČĆĒö╝ 1ņØä 250 mLņ£╝ļĪ£ ĒĢśņŚ¼, S/A/Bļ╣ä 4/1/1 ņĪ░Ļ▒┤ņŚÉņä£ļÅä ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ĻĘĖļ”╝ 8ņŚÉņä£ ņøÉļŻī ņÜ®ņĢĪņØś ļČĆĒö╝Ļ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņłśņé░ĒÖö ļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ņØś ņĀäĒÖśņ£©ņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłĻ│Ā, ĒÖ®ņé░ņ£╝ļĪ£ņØś ņĀäĒÖśņ£©ņØ┤ 5~9% ļŹö ļåÆņĢśļŗż. ņøÉļŻī ņÜ®ņĢĪņØś ļČĆĒö╝Ļ░Ć ņ”ØĻ░ĆļÉ©ņŚÉ ļö░ļØ╝ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ ņĀäĒÖśļÉśņ¢┤ņ¦ĆļŖö ņØ┤ņś©ņØś ņ¢æņØ┤ ņ”ØĻ░ĆĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ēæ£ 6ņŚÉņä£ņÖĆ Ļ░ÖņØ┤ Ļ│ĄņĀĢ ņåīņÜö ņŗ£Ļ░äņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā, ņĀäĒĢ┤ņ¦łņØś ņ¢æņØ┤ ļ¦ÄņĢä ĒÅēĻĘĀ ņĀäļźśļŖö ņ”ØĻ░ĆĒĢśņśĆļŗż. ļśÉĒĢ£ ĒÅēĻĘĀ ņĀäļźśņØś ņ”ØĻ░ĆņÖĆ Ļ│ĄņĀĢ ņŗ£Ļ░äņØś ņ”ØĻ░ĆļĪ£ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ē ņŚŁņŗ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ĻĘĖļ”╝ 9ņŚÉļŖö ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņøÉļŻī ņÜ®ņĢĪ ļČĆĒö╝ ņ”ØĻ░ĆņŚÉ ļ╣äļĪĆĒĢ┤ņä£ ņ”ØĻ░ĆĒĢ£ļŗżļŖö Ļ░ĆņĀĢ ĒĢśņŚÉ ņŗżņĀ£ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēĻ│╝ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ļŖö ļéśĒāĆļé┤ņŚłļŗż. ņøÉļŻī ņÜ®ņĢĪņØś ļČĆĒö╝ ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ē ļ╣äĻĄÉņäĀļ│┤ļŗż ņĢäļלņŚÉ ņ׳ņ¢┤ ņøÉļŻī ņ▓śļ”¼ļ¤ēĻ│╝ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņÖäņĀäĒ׳ ļ╣äļĪĆĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņ┤łĻĖ░ ņé░ĒÜīņłśņŗż, ņŚ╝ĻĖ░ ĒÜīņłśņŗżņŚÉ ļōżņ¢┤Ļ░ĆļŖö ņÜ®ņĢĪĻ│╝ ņøÉļŻī ņÜ®ņĢĪņØś ļČĆĒö╝ ņ░©ņØ┤ņŚÉ ņØśĒĢ£ ļåŹņČĢĻ│╝ ņĀäĒÖśņŚÉ ĒĢäņÜöĒĢ£ ņŚÉļäłņ¦Ć ņåīļ¬©ļ¤ēņØä ļé«ņČ£ ņłś ņ׳ļŗż. ņĢ×ņäĀ ņøÉļŻī ņÜ®ņĢĪņØś ņśüĒ¢ź Ļ▓░Ļ│╝ņÖĆ ĒĢ©Ļ╗ś Ļ│Āņ░░ĒĢśņśĆņØä ļĢī, ļ╣äĻĄÉņĀü ņĀĆļåŹļÅäņØś ĒÖ®ņé░ļ”¼ĒŖ¼ ņøÉļŻī ņÜ®ņĢĪņØä EDBM Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼ ļ░Å ĒÖ®ņé░ņ£╝ļĪ£ ĒÜīņłś ņŗ£ ņČöĻ░ĆņĀüņØĖ Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņøÉļŻī ņÜ®ņĢĪņØä ļåŹņČĢņŗ£ĒéżļŖö Ļ▓āļ│┤ļŗż ļČĆĒö╝ļ╣ä ņĪ░ņĀłņØä ĒåĄĒĢ┤ ĒÜīņłśņÖĆ ļåŹņČĢņØä ļÅÖņŗ£ņŚÉ ĒĢśļŖö Ļ▓āņØ┤ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØä ļé«ņČ£ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
3.6 ļČłņł£ļ¼╝(Na)ņØś ņśüĒ¢źļČłņł£ļ¼╝ļĪ£ ļéśĒŖĖļź©ņØä ņ▓©Ļ░ĆĒĢĀ Ļ▓ĮņÜ░ Ļ│ĄņĀĢņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņé┤ĒÄ┤ļ│┤ĻĖ░ ņ£äĒĢ┤ 0.1 M Li2SO4 ņÜ®ņĢĪņŚÉ ĒÖ®ņé░ļéśĒŖĖļź©ņØä 0.01~0.05 M ņ▓©Ļ░ĆĒĢśņŚ¼, ņĀĢņĀäņĢĢ 20 V ņĪ░Ļ▒┤ņŚÉņä£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ĻĘĖļ”╝ 10ņŚÉ ļČłņł£ļ¼╝ ņ▓©Ļ░Ćļ¤ēņŚÉ ļö░ļźĖ LiOH, NaOHņÖĆ H2SO4ņØś ņĀäĒÖśņ£©ņØä ļéśĒāĆļé┤ņŚłļŗż. ļČłņł£ļ¼╝ņØś ļåŹļÅäĻ░Ć ņĀäĒÖśņ£©ņØś ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ»Ėļ»ĖĒĢśņśĆņ£╝ļ®░, LiOHņØĆ ĒÅēĻĘĀ 75%, NaOHņØĆ 84%, H2SO4ļŖö 78%ļĪ£ ņłśņé░ĒÖöļéśĒŖĖļź©ņØś ņĀäĒÖśņ£©ņØ┤ Ļ░Ćņן ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż. Ēæ£ 7ņŚÉņä£ ļČłņł£ļ¼╝ņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒÅēĻĘĀ ņĀäļźś, Ļ│ĄņĀĢ ņŗ£Ļ░ä, ņŚÉļäłņ¦Ćņåīļ╣äļ¤ēņØĆ ļ¬©ļæÉ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ĒĢ£ ņ¢æņØ┤ņś© ĻĄÉĒÖśļ¦ēņØĆ Na typeņØś ļ¦ēņ£╝ļĪ£ 2Ļ░Ć ņ¢æņØ┤ņś©ņŚÉ ļīĆĒĢ£ ņäĀĒāØņä▒ņØĆ ņÜ░ņłśĒĢśņ¦Ćļ¦ī, 1Ļ░Ć ņ¢æņØ┤ņś©ņŚÉ ļīĆĒĢ£ Ēł¼Ļ│╝ ņäĀĒāØņä▒ņØĆ ļé«ĻĖ░ ļĢīļ¼ĖņŚÉ 1Ļ░Ć ņ¢æņØ┤ņś©ņØĖ Li+ņÖĆ Na+ ļ¬©ļæÉ ĒåĄĻ│╝ņŗ£ņ╝£ ņøÉļŻī ņÜ®ņĢĪ ņżæņŚÉ Li+ļ¦īņØä ņäĀĒāØņĀüņ£╝ļĪ£ Ēł¼Ļ│╝ĒĢśņŚ¼ LiOHļĪ£ ĒÜīņłśĒĢĀ ņłś ņŚåļŗż. ņøÉļŻī ņÜ®ņĢĪ ņżæ Li+Ļ│╝ Na+Ļ░Ć Ēś╝ĒĢ®ļÉśņ¢┤ ņĪ┤ņ×¼ĒĢĀ Ļ▓ĮņÜ░ ĒāłņŚ╝Ļ│╝ ļÅÖņŗ£ņŚÉ ņłśņé░ĒÖöļ¼╝ļĪ£ņØś ņĀäĒÖśņØĆ Ļ░ĆļŖźĒĢśļéś, ļæÉ ņä▒ļČäņØä ļČäļ”¼ĒĢśņŚ¼ ĒÜīņłś ĒĢĀ ņłśļŖö ņŚåņŚłļŗż. ļśÉĒĢ£ ņ▓ĀĻ│╝ ļŗłņ╝ł ļō▒ņØĆ Ļ│ĄņĀĢ ņżæ ņÜ®ņĢĪ pH ļ│ĆĒÖöņŚÉ ļö░ļźĖ ņŖżņ╝ĆņØ╝ Ēś╣ņØĆ ļČłņÜ®ņä▒ ņłśņé░ĒÖöļ¼╝ņØä ĒśĢņä▒ĒĢĀ ņłś ņ׳ņ¢┤ ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢ ņĀä ļ░śļō£ņŗ£ ņĀ£Ļ▒░ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.
4. Ļ▓░ ļĪĀĒÖ®ņé░ļ”¼ĒŖ¼ņłśņÜ®ņĢĪņØä ņøÉļŻīņÜ®ņĢĪņ£╝ļĪ£ ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢņŚÉ ņĀüņÜ®ĒĢśņŚ¼ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ĻĖ░ņ┤ł ņŚ░ĻĄ¼ļź╝ ņŗżņŗ£ĒĢ£ Ļ▓░Ļ│╝, ļŗżņØīĻ│╝ Ļ░ÖņØĆ Ļ▓░ļĪĀņØä ņ¢╗ņØä ņłś ņ׳ņŚłļŗż.
1) ņØĖĻ░ĆņĀäņĢĢņŚÉ ļö░ļźĖ ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ Ļ▓░Ļ│╝ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©, ņŚÉļäłņ¦Ćņåīļ╣äļ¤ē ļ░Å Ļ│ĄņĀĢ ņåīņÜöņŗ£Ļ░äņØä Ļ│ĄņĀĢ ņØĖņ×ÉļĪ£ Ļ│ĀļĀżĒĢśņśĆņØä ļĢī, ņØĖĻ░ĆņĀäņĢĢņØ┤ ĒÖ®ņé░ ņĀäĒÖśņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ»Ėļ»ĖĒĢśņśĆĻ│Ā, ņłśņé░ĒÖöļ”¼ĒŖ¼ ņĀäĒÖśņ£©ņØĆ ņØĖĻ░ĆņĀäņĢĢņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ļŗżņåī Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ē Ļ┤ĆņĀÉņŚÉņä£ļŖö ļé«ņØĆ ņØĖĻ░ĆņĀäņĢĢņØ┤ ņ£Āļ”¼ĒĢśļéś, ĻĖ┤ Ļ│ĄņĀĢ ņŗ£Ļ░ä ļĢīļ¼ĖņŚÉ Ļ│ĄņĀĢ ņŗ£Ļ░ä 28ļČä, ņŚÉļäłņ¦Ćņåīļ╣äļ¤ēņØ┤ 4.40 kWh/m3ņØĖ Ļ│ĄņĀĢ ņÜ┤ņĀä ņĀäņĢĢ 20 VĻ░Ć ļ░öļ×īņ¦üĒĢśļŗż.
2) ņøÉļŻī ņÜ®ņĢĪņØĖ ĒÖ®ņé░ļ”¼ĒŖ¼ņØś ņ┤łĻĖ░ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØĆ ņ”ØĻ░ĆĒĢśļŗżĻ░Ć Ļ░ÉņåīĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ĒÖ®ņé░ļ”¼ĒŖ¼ņØś ļåŹļÅä ņ”ØĻ░Ć ļīĆļ╣ä ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņäĀĒśĢņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņ¦Ć ņĢŖĻ│Ā, ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ļŹö Ēü░ ĒÅŁņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņØĖĻ░ĆņĀäņĢĢ 15 Vļ│┤ļŗż ņØĖĻ░ĆņĀäņĢĢ 30 VņØ╝ Ļ▓ĮņÜ░ ņøÉļŻī ņÜ®ņĢĪņØś ļåŹļÅä ņ”ØĻ░Ć ļīĆļ╣ä ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØś ņ”ØĻ░Ć ĒÅŁņØ┤ Ēü¼ņ¦Ć ņĢŖĻ│Ā, Ļ│ĄņĀĢ ņŗ£Ļ░äļÅä ņ¦¦ĻĖ░ 0.5 M Li2SO4 ņØ┤ņāüņØś ņøÉļŻīņÜ®ņĢĪņØä ļ░öņØ┤ĒÅ┤ļØ╝ ņĀäĻĖ░Ēł¼ņäØ Ļ│ĄņĀĢņŚÉ ņĀüņÜ®ĒĢĀ Ļ▓ĮņÜ░ ņØĖĻ░ĆņĀäņĢĢ 30 VņØ┤ ļ░öļ×īņ¦üĒĢśļŗż.
3) ļ░śņØæ ņŗ£Ļ░äĻ│╝ ņØĖĻ░ĆņĀäņĢĢņŚÉ ļö░ļźĖ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØä Ļ│Āņ░░ĒĢ£ Ļ▓░Ļ│╝, ņØĖĻ░ĆņĀäņĢĢņØ┤ ļåÆņØäņłśļĪØ ĒÖ®ņé░ļ”¼ĒŖ¼ņØ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņ£╝ļĪ£ ļŹö ļ╣Āļź┤Ļ▓ī ņĀäĒÖśļÉśņŚłņ£╝ļ®░, 0.2 M Li2SO4ļź╝ ņøÉļŻī ņÜ®ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ņØĖĻ░ĆņĀäņĢĢ 20 Vļ│┤ļŗż 25 VņŚÉņä£ ļæÉ ļ░░ ņØ┤ņāü ļ╣Āļź┤Ļ▓ī ņĀäĒÖś ļÉśņŚłļŗż.
4) ņĀäĻĘ╣ņĢĪņ£╝ļĪ£ NaOH ņÜ®ņĢĪņØä ņé¼ņÜ®ĒĢśņśĆņØä ļĢī, ņĀäĻĘ╣ņĢĪņØś ļåŹļÅäĻ░Ć ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ ņĀäĒÖśņ£©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ņŚåņŚłļŗż. ņĀäĻĘ╣ņĢĪ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ│ĄņĀĢ ĒÅēĻĘĀ ņĀäļźśļŖö ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś Ļ│ĄņĀĢ ņŗ£Ļ░äņØ┤ ļŗ©ņČĢļÉśņ¢┤ ņŚÉļäłņ¦Ćņåīļ╣äļ¤ēņØĆ Ļ░ÉņåīĒĢśņśĆļŗż. 3.0 wt% ņĀäĻĘ╣ņĢĪļ│┤ļŗż 5.0 wt% ņĀäĻĘ╣ņĢĪņØä ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ņŚÉļäłņ¦Ćņåīļ╣äļ¤ēņØ┤ 10% ņØ┤ņāü Ļ░ÉņåīĒĢśņśĆļŗż.
4) ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØä ļåŹņČĢĒĢśņŚ¼ ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ┤ ņøÉļŻīņÜ®ņĢĪ ļČĆĒö╝ļź╝ ņ”ØĻ░Ćņŗ£ņ╝£ ļČĆĒö╝ļ╣ä(S/A/B)ļź╝ ņĪ░ņĀłĒĢśņśĆņØä Ļ▓ĮņÜ░ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ņĀäĒÖśņ£©ņØĆ ļŗżņåī ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ņøÉļŻīņÜ®ņĢĪņØś ļČĆĒö╝ ņ”ØĻ░Ć ļīĆļ╣ä ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņäĀĒśĢņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņŚ¼, ļ╣äĻĄÉņĀü ļé«ņØĆ ļåŹļÅäņØś ņøÉļŻī ņÜ®ņĢĪņØä ņ▓śļ”¼ĒĢĀ Ļ▓ĮņÜ░ ļČĆĒö╝ļ╣ä ņĪ░ņĀłņØä ĒåĄĒĢ┤ ņłśņé░ĒÖöļ”¼ĒŖ¼Ļ│╝ ĒÖ®ņé░ņØś ĒÜīņłś┬ĘļåŹņČĢņØ┤ ļÅÖņŗ£ņŚÉ Ļ░ĆļŖźĒĢśļŗż.
5) ļČłņł£ļ¼╝ļĪ£ ļéśĒŖĖļź©ņØ┤ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓ĮņÜ░ ļČłņł£ļ¼╝ ņ¢æņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ│ĄņĀĢ ņŗ£Ļ░äĻ│╝ ņŚÉļäłņ¦Ć ņåīļ╣äļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ļ”¼ĒŖ¼Ļ│╝ ļéśĒŖĖļź©ņØä ļČäļ”¼ĒĢśņŚ¼ ĒÜīņłś ĒĢĀ ņłśļŖö ņŚåņŚłļŗż.
Acknowledgmentsļ│Ė ņŚ░ĻĄ¼ļŖö 2020ļģäļÅä ņé░ņŚģĒåĄņāüņ×ÉņøÉļČĆņØś ņ×¼ņøÉņ£╝ļĪ£ ĒĢ£ĻĄŁņŚÉļäłņ¦ĆĻĖ░ņłĀĒÅēĻ░ĆņøÉ(KETEP)ņØś ņ¦ĆņøÉņØä ļ░øņĢä ņłśĒ¢ēĒĢ£ ņŚ░ĻĄ¼Ļ│╝ņĀ£(No. 20185210100050)ņØ┤ļ®░, ņØ┤ņŚÉ Ļ░Éņé¼ļō£ļ”Įļŗłļŗż.
Fig.┬Ā3.Effect of applied voltage on the conversion (0.1 M Li2SO4, 4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)). 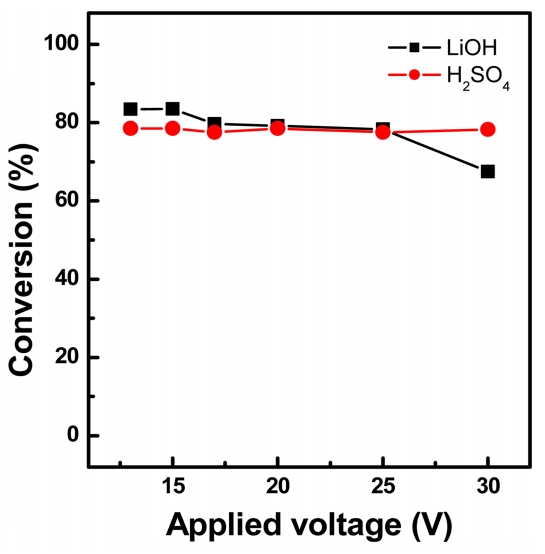
Fig.┬Ā4.Effect of applied voltage & intial Li2SO4 concentration on the conversion (4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)). 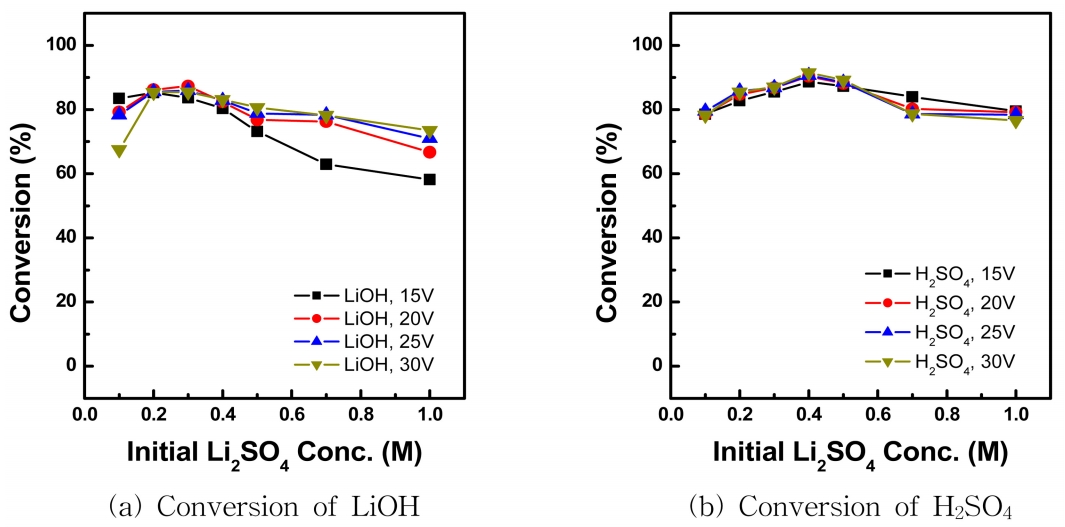
Fig.┬Ā5.Effect of applied voltage & intial Li2SO4 concentration for energy consumption (4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)). 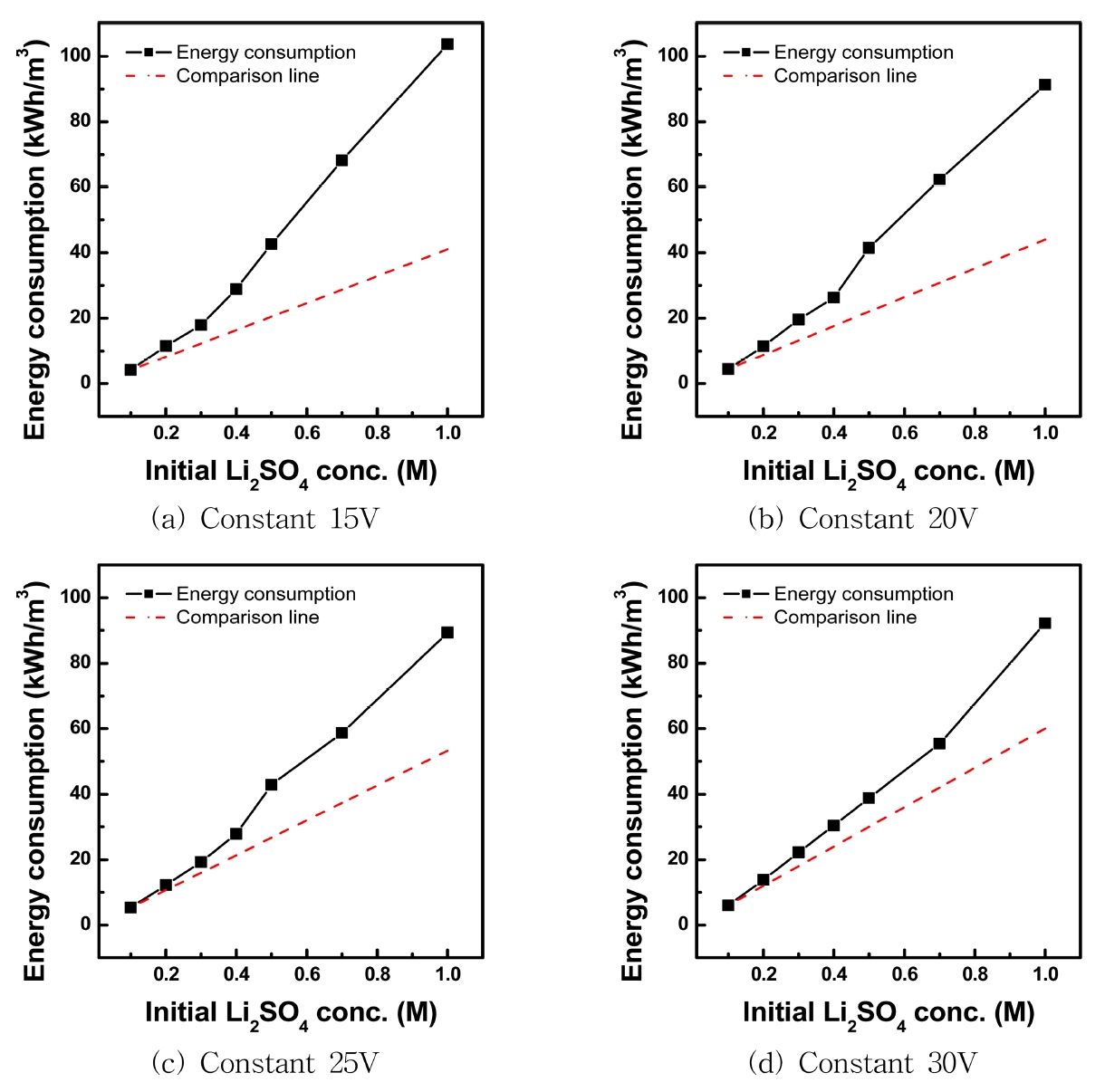
Fig.┬Ā6.Effect of process time on the conversion (0.2 M Li2SO4, 4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)) 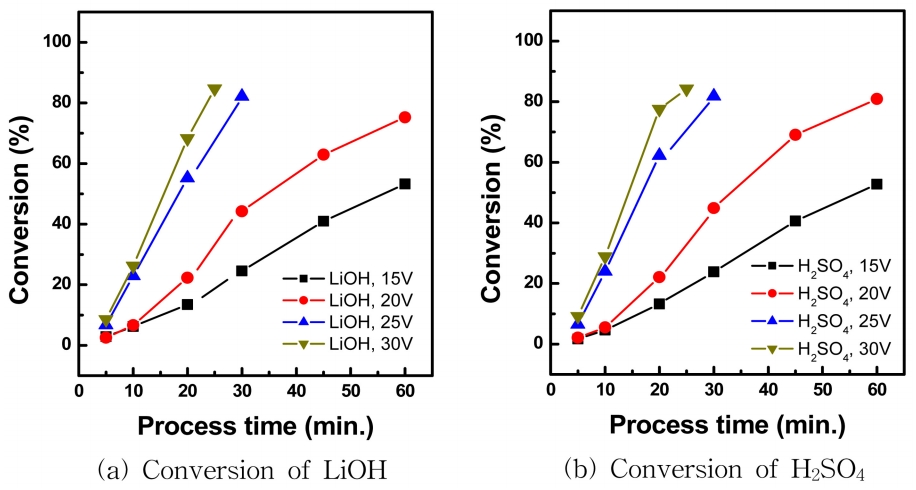
Fig.┬Ā7.Effect of electrode solution concentration on the conversion (0.1 M Li2SO4, constant 15 V, S/A/B = 1/1/1 (1=500 mL)). 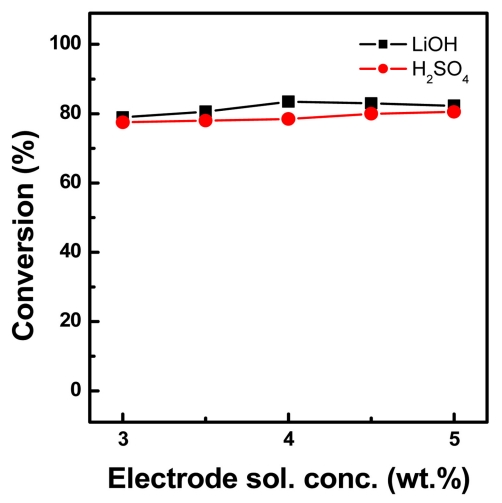
Fig.┬Ā8.Effect of initial volume ratio on the conversion (0.1 M Li2SO4, constant 20 V, 4.0 wt% NaOH). 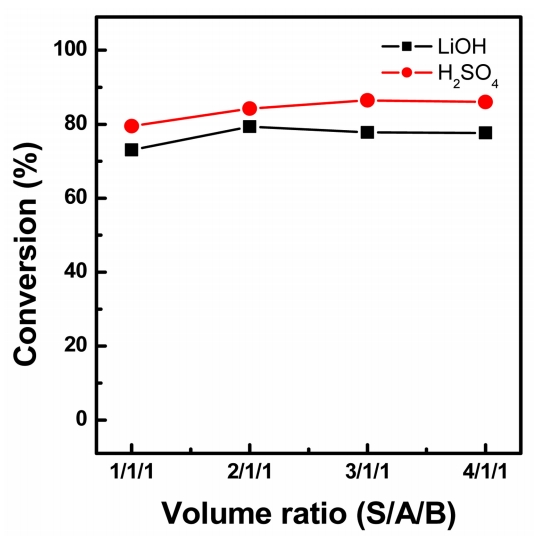
Fig.┬Ā9.Effect of initial volume ratio for energy consumption (0.1 M Li2SO4, constant 20 V, 4.0 wt% NaOH). 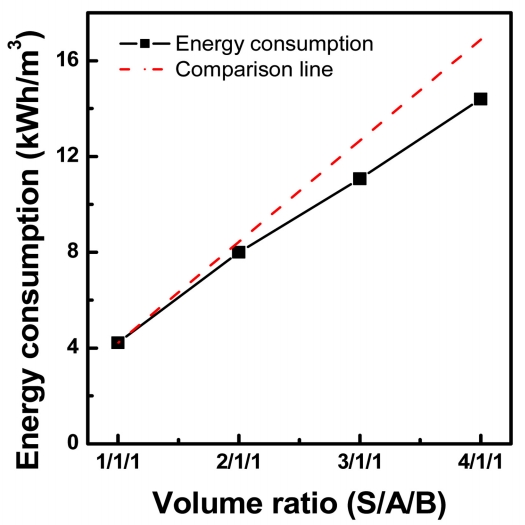
Fig.┬Ā10.Effect of impurity on the conversion (0.1 M Li2SO4, constant 20V, 4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)). 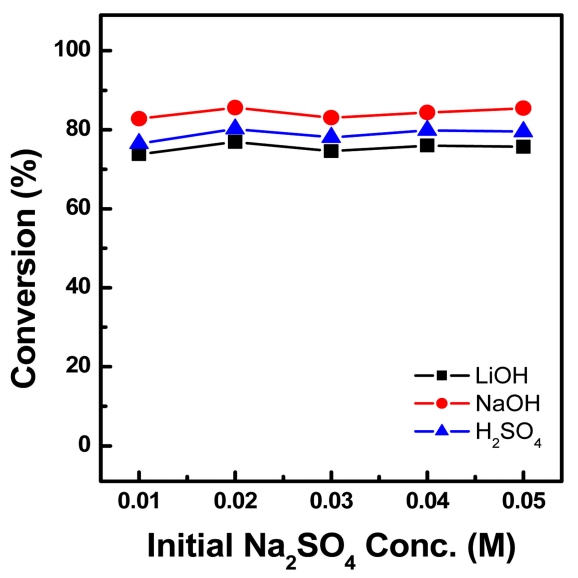
Table┬Ā1.Specifications of EX3B Bipolar Membrane Electro Dialyzer. Table┬Ā2.Specifications of bipolar, cation and anion exchange membrane. Table┬Ā3.Experimental result for applied voltage (0.1 M Li2SO4, 4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)).
Table┬Ā4.Experimental result for applied voltage & intial Li2SO4 concentration (4.0 wt% NaOH, S/A/B = 1/1/1 (1=500 mL)). Table┬Ā5.Experimental result for electrode solution concentration (0.1 M Li2SO4, constant 15 V, S/A/B = 1/1/1 (1=500 mL)). Table┬Ā6.Experimental result for initial volume ratio (0.1 M Li2SO4, constant 20 V, 4.0 wt% NaOH). REFERENCES2. M. K. Jha, A. Kumari, A. K. Jha, V. Kumar, J. Hait, and B. D. Pandey, Waste Manag. 33, 1890 (2013).
5. R. A. Rasmussen, C. W. Lewis, R. K. Stevens, W. D. Ellenson, and S. L. Dattner, Environ. Sci. Technol. 30, 1092 (1996).
6. S. Li, H. Huang, X. Yang, Y. Bai, J. Li, N. Kobayashi, and M. Kubota, Appl. Therm. Eng. 128, 706 (2018).
11. S. Joo, Y. Kang, H.-W. Shim, S.-H. Byun, Y. H. Kim, C.-G. Lee, and D.-G. Kim, Resour. Recycl. 28, 60 (2019).
15. M. Mulder, Membrane Processes in Seperation and Purification, pp. 227ŌĆō356, Kulwer Academic Publishers, Netherlands (1993).
16. G. Belfort, Synthetic Membrane Processes-Fundamental and Water applications, pp. 1ŌĆō19, Academic Press, US (1984).
17. S.-I. Chung, C.-H. Ryu, A.-S. Kang, and H.-S. Lee, J. Korean Ind. Eng Chem. 14, 95 (2003).
18. S. H. Kwon, MasterŌĆÖs Thesis. 1ŌĆō16, Hannam University, Daejeon (2016).
19. T. H. Ko, MasterŌĆÖs Thesis. 14ŌĆō19, Gyeongsang National University, Busan (2020).
20. J. Magnan, G. Bourassa, G. Pearse, P. Symons, D. J. Genders, D. Bar, and M. Langevin, Processes for preparing lithium hydroxide. https://patents.google.com/patent/US20160032471A1/sv. (2016).
21. S. K. Park, K. S. Park, S. G. Lee, W. C. Jung, J. Y. Wi, H. W. Lee, W. K. Park, and D. S. Kim, KR Patent. https://patents.google.com/patent/KR20180074177A/ko?oq=KR++20180074177A. (2018).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||