AbstractThe incomplete elimination of oxide scale formed during the normalizing process can result in severe degradation of the surface and mechanical properties of ultra-strong steels. This study revealed that the formation of oxide scale was highly dependent upon the alloying elements Ni and Cu. Ni-bearing steel showed a much higher oxidation rate, resulting in much thicker scale than Cu-bearing steel. Uneven scale/steel interfaces and oxide penetration along the grain boundary of the steel were clearly observed in the Ni-bearing steel. The difference in the solid solubility limit of Ni and Cu to austenite could lead to the enrichment of Ni and precipitation of Cu at scale/steel interfaces in the two types of steels, respectively. This resulted in the different structure and properties of the oxide scales, which influenced the subsequent corrosion behavior in chloride containing conditions. Linear polarization resistance measurements showed that the addition of Ni and Cu to the steel had a beneficial influence on the corrosion resistance, by suppressing the anodic dissolution and cathodic reduction reactions of Ni and Cu-bearing steels, respectively. This study provided a proposed mechanism for the difference in corrosion behaviors between the two types of steel.
1. 서 론최근 자동차 산업에서는 차체의 구조적 안정성 및 경량화에 따른 연비절감 효과를 동시에 확보하기 위해 1.5 GPa 이상의 인장강도를 갖는 초고강도급 강재를 적용하려는 노력이 이루어지고 있다 [1-3]. 이에 따라 최근 대형 철강사를 중심으로 1 GPa 이상의 인장강도와 함께, 우수한 인성 및 연성 특성을 보증하는 마르텐사이트계 초고강도급 강재 개발이 활발히 이루어지고 있으며, 자동차 차체 및 샤시 부품으로의 적용 영역을 확대하고 있는 추세에 있다 [4].
초고강도급의 강도 확보를 위해, 강재 내 미세조직을 마르텐사이트로 형성시키려는 열처리 조건을 확립하고 있으나, 마르텐사이트 조직은 본질적으로 내식성 및 수소취화 저항성의 감소를 초래하게 된다. 선행연구 결과에 따르면, 강재 표면에서 발생하는 전기화학적 부식 반응은 내부 잔류응력 및 전위밀도와 같은 조직 내 결함 수준에 지배적인 영향을 받는다고 보고되고 있다 [5,6]. 이에 따라, 학계 및 산업계에서는 마르텐사이트계 초고강도급 강재의 내식성 및 수소취화 저항성을 향상시키기 위한 효과적인 합금설계 방향 및 표면처리법 제시가 당면한 과제로 대두되고 있다 [7-11]. 고내식 특성 확보를 위한 방안으로서 강재 내 Cr, Mo, Cu, Ni 등의 합금원소 첨가가 제시될 수 있다. 특히 Cr 첨가의 경우, 표면에 형성된 부동태피막이 내부 강재와 외부 부식 환경을 격리하여 강재의 양극용해반응을 억제하는 효과가 대표적인 방식기구로 보고되고 있다 [9-11]. 하지만, 고내식 특성을 목적으로 첨가한 합금성분은 균일 부식 저항성을 향상시키는 이점을 확보할 수 있으나, 합금성분의 함량이 증가함에 따라 국부부식 발생의 위험이 증가될 수 있다 [12-15]. 또한, Kondo [16]와 Fukagawa [17]는 강재의 초고강도 특성 확보를 위한 열처리 (노말라이징) 진행 중, 강재 표면에 필연적으로 형성되는 표면의 고온 산화 scale이 강재의 물성을 저하시키는 요인으로 작용할 수 있으며, 물성저하의 정도는 강재에 첨가된 합금성분의 종류와 양에 크게 의존하는 것으로 보고한 바 있다. 특히, 고온 열처리를 통해 파이프형태로 가공된 마르텐사이트계 강재를 자동차 샤시 부품으로 적용시키기 위해서는 산화 scale 형성에 따른 물성저하 효과를 최소화시켜야 할 것이다. 실제로 산업체에서 강재 표면의 산화 scale을 효과적으로 제거시키기 위해 shot blasting 또는 chemical etching과 같은 후처리 작업이 필수적으로 수반되고 있으나, 고온에서 형성된 산화 scale의 경우, 일반 저온 부식 환경에서 형성된 부식 생성물 대비 밀착성과 표면 경도가 높기 때문에 scale의 완전한 제거가 힘들다. 특히, 산업현장 내 파이프 내벽의 후처리 작업이 효율적으로 이루어지기 위한 추가 공정이 요구된다. 이 경우, 파이프 내벽에 잔존한 scale이 표면 결함으로 작용할 수 있으며 [18], 향후 자동차 부품으로 적용 시, 부식 저항성 및 응력부식 균열 저항성을 크게 낮출 수 있는 효과를 배제할 수 없다. 이에, 본 저자는 우선, 고온 열처리를 통한 강재의 산화특성 및 산화 scale 형성거동에 대한 분석을 수행하고자 하였다. 일반적으로 강재의 고온 산화 시, 산화 scale 형성 및 특성에 영향을 미치는 인자로서는, 열처리 온도 [19,20], 산소 분압 [21,22], 수증기의 존재 [23] 및 강재 내 첨가되는 다양한 합금성분 [24-28] 등이 있으며, 본 연구에서는 합금성분에 따른 산화 scale의 형태 및 특성변화에 주목하였고, 이렇게 강재 표면에 기 형성된 scale이 저온환경 내 부식 거동에 미치는 효과에 대해 초점을 맞추어 연구를 진행하였다. 이를 위해, 본 연구에서는 1.5 GPa 이상의 인장강도를 갖는 초고강도급 마르텐사이트계 강재를 대상으로 Ni 및 Cu의 합금원소 별 고온 산화 scale의 형성 거동의 차이를 논하며, 아울러, 형성된 scale 층의 특성이 저온환경 내에서 보이는 부식 거동에 미치는 효과를 분석하고자 하였다.
2. 실험방법2.1. 열처리 및 고온 산화 scale 단면 분석본 실험에서 사용된 시편은 표 1에 나타낸 바와 같이 0.39~0.4 wt% C, 0.9~1.0 wt% Mn을 주 성분으로 하는 1.5 GPa 이상의 인장강도를 갖는 초고강도급 강재이다. 합금성분 (Ni 및 Cu)이 고온 산화 scale의 특성에 미치는 영향을 확인하기 위해 각각 0.3, 0.7, 1.2 wt% Ni 첨가 및 0.3, 0.7, 1.2 wt% Cu 첨가를 하였다. 이후 A3 변태온도 이상의 930 °C에서 7 min 동안 노말라이징한 후 수냉을 실시하여 기지 내 마르텐사이트 조직을 형성시켰다. 고온 열처리 과정 중 시편 표면에 형성된 scale의 단면 형상 관찰을 위해, 시편을 mounting한 후 SiC 사포를 이용해 #1200까지 연마하였다. 연마된 단면을 0.1% nital 용액으로 에칭한 후 ethanol로 세척한 뒤 광학현미경 (Optical microscopy, OM), 주사전자현미경 (Field emission scanning electron microscopy, FE-SEM)을 활용하여 scale과 matrix 계면 형상을 관찰하였다.
2.2 고온 무게 변화강재 내 첨가된 Cu 및 Ni 합금성분에 의한 고온 산화 거동을 분석하기 위해 대표적으로 #3 (Ni 첨가), #6 (Cu 첨가) 시편을 대상으로 하여, 1 × 1 × 0.5 (cm) 크기의 시편을 제작한 후 열처리를 수행하였다. 열처리는 각 930 °C에서 각각 1, 3, 5, 7 min으로, 열처리 유지 시간을 달리하는 조건으로 진행하였다. 열처리된 시편은 수냉 이후 건조시켜 무게를 측정하였다. 열처리 및 수냉 처리 시 시편으로부터 분리되어 떨어져 나가는 일부 산화 scale로 인해 야기될 수 있는 무게측정의 오류를 최소화시키고자 상기 처리 시 분리되는 scale만을 재수집하여 이를 무게측정에 반영하였다. 이후 측정된 실험 결과를 통해 고온 산화 속도에 대한 정량적 분석을 진행하였고 이때, 사용된 식은 다음과 같다.
선형 구간 (~1 min) :
곡선 구간 (1 min ~) :
여기서 ΔMass change는 측정된 무게 증가량, kp는 고온 산화 속도 상수, t는 온도 유지 시간을 나타낸다.
2.3. XRD 분석강재 표면에 형성되는 고온 산화 Scale의 종류를 확인하기 위해 대표적으로 #3, #6 시편을 930 °C에서 7 min 동안 노말라이징 및 수냉 처리하여 표면에 산화 scale을 형성시킨 후 X-선 회절 (X-ray diffraction, XRD) 분석을 수행하였다.
2.4. 선형 분극 거동 분석
그림 1은 실험에 사용된 flat cell의 간단한 모식도를 나타낸다. 본 전기화학 실험을 위해 3전극 (Working electrode (WE), Counter electrode (CE), Reference electrode (RE)) system을 활용하였고, 기준전극 (RE)으로 포화 칼로멜 전극 (Saturated calomel electrode, SCE)을 사용하였다. 고온 열처리를 통해 우선 산화된 시편의 표면 산화 scale을 대상으로, 저온 수용액 환경 내 개방회로전위 (Open circuit potential, OCP) 인근영역의 분극 거동을 평가하기 위해, 중성의 염화물 환경인 3.5% NaCl 용액에서 OCP 대비 ±20 mVSCE 범위의 전위를 0.2 mV/s의 속도로 인가하는 조건으로 침지 후 3, 6, 24 h의 시간 별로 선형분극 저항 (Linear Polarization Resistance, LPR) 실험을 수행하였다. 산화된 시편을 대상으로 flat cell을 활용하여 전기화학실험 시, cell 내 시편장착부 O-ring에 의해 일부 산화층의 변형이 수반될 수 있으며 이로 인한 전기화학적 거동 변화/차이의 존재유무를 우선 파악하고자 하였다. Flat cell을 사용하여 도출한 실험 data와 flat cell을 사용하지 않고, 시편 전 영역을 침지하여 실험 후 도출한 실험 data를 비교/평가하는 선행실험을 수행하였으며, 결과적으로 시편장착부 산화층의 일부 변형에 따른 부작용은 본 연구 내에서는 배제할 수 있는 수준인 것으로 판단하였다.
LPR 실험을 통해 도출된 결과 (LPR을 통해 OCP 인근 영역 하에서 음극/양극의 분극곡선 (X축: 전류밀도, Y축: 전위) 도출)를 바탕으로, 실험값 (LPR을 통한 분극곡선 data)과 Wagner-Traud 방정식 (3) 및 Stern-Geary 방정식 (4)을 이용한 이론값의 curve-fitting을 통하여 강재 표면에 형성된 산화 scale이 중성의 저온 수용액 부식 거동에 미치는 영향을 정량적으로 분석하고자 하였다.
여기서 icorr는 부식 전류밀도 (A/cm2), Ecorr는 부식 전위 (V), E는 측정된 전위 (V), i는 fitting 된 이론 전류밀도 (A/cm2), Rp는 분극 저항 (Ω·cm2), βa, βc는 각각 산화·환원 Tapel 기울기 (V/decade)를 나타낸다.
Curve-fitting을 통한 부식변수 값 (βa, βc, Rp 등) 도출의 경우, 실험치와 이론치 차이의 최소값을 구하는 방식으로 이루어졌으며 이는 아래 식으로 요약될 수 있다.
여기서 Iexp 및 Ical는 각각 주어진 전위 값에서의 실험치인 전류밀도와 이론치인 전류밀도를 나타내며, n은 전체 data 개수를 의미한다.
LPR 실험을 통해 측정된 Rp 값과 Stern-Geary 식을 통해 계산된 icorr 값을 이용해 부식 속도 (Mills per year, MPY)가 결정되었으며, 이를 위해 계산된 식은 다음과 같다.
여기서 Λ는 1.2866×10-5 (equivalents·s·mil)(Coulombs·cm·years)-1, ε은 철의 당량 (27.56 (equivalent for iron)-1), ρ는 철의 밀도 (7.86 g/cm3)를 나타낸다.
3. 결과 및 고찰3.1. 고온 산화 후 단면 관찰산소가 존재하는 고온 환경에 강재가 노출될 경우, 강재는 산화되며, 표면에 산화 scale이 형성된다. 일반적으로, 산화 scale의 성장 속도는 온도, 시간, 대기 성분에 의존하며, 특히 산소 분압에 지배적인 영향을 받는 것으로 알려져 있다 [29]. 산화 scale은 주로 wustite (FeO), magnetite (Fe3O4), hematite (Fe2O3)의 3가지 산화층으로 구성되며, 다음과 같은 반응에 기초하여 형성된다 [30].
산화 scale/steel 계면에는 FeO, scale 바깥층은 Fe2O3, FeO와 Fe2O3 사이는 Fe3O4 층이 형성되는 것으로 알려져 있으나 [31], 합금성분의 첨가로 인해 산화 scale의 형상 및 특성이 변화될 수 있다. 그림 2는 각각 Ni 및 Cu 성분이 첨가된 시편의 고온 열처리 후, 표면에 형성된 scale 단면을 SEM으로 관찰한 결과를 나타낸다. 우선 Ni 첨가강의 경우 (그림 2(a~c)), 합금첨가에 따른 scale 층의 두께 증가 정도가 Cu 첨가강 대비 확연하게 두드러졌다. 0.7 wt% 이상의 동일 첨가량 기준으로, Cu 첨가강 대비 두 배 정도의 scale 층 두께 증가가 이루어진 것으로 확인되었다. 뿐만 아니라, scale/steel 계면의 평탄함 정도가 현저히 낮았으며, 하부 steel 내부로 scale의 국부 침투 정도가 높은 것으로 나타났다. 이를 보다 명확히 확인하고자 #3 시편을 대상으로 시편의 단면부를 에칭한 후 SEM을 통해 계면을 확대하여 관찰한 결과 (그림 3), 기 관찰된 scale의 국부 침투경로는 주로 하부 steel의 결정립계로 확인되었다. Scale이 하부 steel 결정립계로 침투된 양상은 Ni 함량이 증가할수록 보다 두드러졌고, 깊이가 더욱 증가하였다. 반면, 그림 2(d~e)는 Cu 함량 증가에 따른 산화 scale의 형상/두께 변화를 나타낸 것으로 Ni 첨가강 대비 각각 동일 함량에서 산화 scale의 두께가 현저히 낮았으며, scale/steel 계면의 형상이 비교적 평탄하였다.
3.2. 고온 산화 후 무게 변화와 산화 메커니즘930 °C에서 열처리 시 유지 시간에 따른 무게 변화를 측정하여 산화된 정도를 판단하고자 하였고, 그 결과를 그림 4에 나타내었다. Cu, Ni 합금강 모두 열처리 유지 시간에 따라 mass gain이 증가하였는데, Cu 첨가강의 경우, Ni 첨가강 대비 각각의 열처리 시간에 따라 전체적으로 낮은 mass gain이 측정되었다. 선행 연구에 따르면, 산화 초기에는 mass gain이 선형적으로 증가되며 급격한 기울기로 빠른 산화 속도를 나타내지만, 충분한 산화 진행 후에는 초기 대비 느린 산화 속도를 나타내며 포물선 형태로 증가 (parabolic growth) 되는 것으로 보고되고 있다 [32]. 또한, 고온에서 철의 산화는 수십 초 동안 선형적인 구간을 보이며, 이후 곡선 구간을 나타낸다 [33]. 본 연구에서는 열처리 시작 시간으로부터 1 min 동안의 산화를 선형적인 구간으로, 1 min 이후를 곡선 구간으로 판단하였고, 식 (1)과 (2)를 통해 고온 산화 상수 (kp) 값을 계산하여 표 2에 나타내었다. 산화 초기에는 Ni 첨가강이 Cu 첨가강 대비 약 1.5배 정도 높은 kp 값을 보였으며, 이후 곡선 구간에서는 약 10배 높은 kp 값을 보여주었다.
일반적으로 Steel 내 Ni 및 Cu가 소량 첨가되어 산화된 경우, Fe가 Ni 및 Cu 대비 농도가 훨씬 높고 산소와의 친화력이 강한 활성원소이므로 Fe의 우선산화를 통해 Fe 기반의 scale이 우선 생성되고, scale/steel 계면에는 Ni 및 Cu가 농화되는 것으로 알려져 있다 [16,17,34]. 우선 Ni 첨가강의 경우, 고온 산화 시, 표면에 FeO/Fe2O3/Fe3O4 등으로 구성된 다층 scale 뿐 아니라 내부산화물로, FeO 성분의 Fe 산화물 [16,17,35] 또는 NixFe3-xO4 산화물 [16,35]의 형성이 가능한 것으로 보고되고 있다. Fe-2% Ni 합금소재의 고온산화에 대한 연구결과를 보고한 Lee [35] 또한 고온 산화 시 형성된 scale 내의 기공 및 미세 결함 등을 통해 침투된 산소에 의해 산화막 직하에 Ni이 소량 고용된, 둥근 형태의 내부산화물이 다수 형성됨을 보였다. 고온에서 산화된 Ni 첨가강 내부에 형성되는 내부산화물에 대해 Kondo [16]는 Ni의 첨가로 인한 농화층 형성은 Fe의 활동도를 감소시켜 결국 Fe의 내부산화를 조장하는 것으로 설명하였다. 본 연구에서도 #3 시편의 산화 후 scale 하단부 SEM 관찰 (그림 5) 시, 내부산화물로 추측되는 입자가 관찰되었다. 다만 크기가 미세하여 정확한 정량분석은 이루어지지 않았으나, 선행연구결과 [16,33-35]들을 토대로 Ni의 첨가는 내부산화물의 형성을 조장하는 것으로 판단된다. 반면, Cu 첨가강인 #6 시편의 산화 후 scale 하단 부 SEM 관찰 (그림 5) 시에는 내부산화물로 추측되는 입자가 전혀 관찰되지 않았다. Cu의 경우, Ni과 마찬가지로 강 내에 첨가되어 산화가 이루어지면 Fe의 우선산화로 인해 Cu가 계면에 농화될 것으로 예상할 수 있으나 Cu의 농화 대신 Cu의 석출현상 [16,36]이 논의되고 있다. Fe-Cu 평형상태도에 따르면, 930 °C의 온도에서 Fe 내 Cu의 고용한도는 대략 2~3% [16,34,36]에 불과하다. 전 조성영역에서 완벽한 고용이 이루어지는 Fe-Ni의 경우 [34,37]와는 대조적이라 할 수 있다. 이를 토대로 Cu 첨가강의 경우 Ni 첨가강 대비 농화층 형성이 제한적으로만 이루어지며 일부 metallic Cu의 형태로 석출이 이루어질 수 있음을 짐작할 수 있고, 결국 Ni 첨가강과 대비하여 steel 내부 Fe의 활동도 저하가 심하지 않고, 내부산화에 대한 진행 또한 상대적으로 더딜 것으로 예상된다. 앞서 논의한 부분들을 보다 명확히 하기 위해 XRD 분석을 수행하였고 그림 6에 그 결과를 나타내었다. Ni 첨가강 (#3)의 경우, FeO, Fe3O4의 산화 Scale 이외에 FeNi의 금속간화합물이 일부 형성되었음을 알 수 있고, 반면 Cu 첨가강 (#6)의 경우 FeO, Fe3O4 이외에 Fe2CuO4와 metallic Cu가 검출되었다. 우선 metallic Cu 성분검출의 경우, 앞서 논의하였던 바와 같이 Fe 내 Cu의 고용도가 극히 낮아 metallic의 형태로 일부 석출되어 계면에 존재하다 산화가 진행되면서 scale 내부로의 잠식이 이루어지며 scale을 구성하던 Fe3O4에서 Fe 자리 일부에 Cu가 치환된 형태를 가지는 것으로 판단할 수 있다.
앞서 논의한 부분들을 바탕으로 Ni 및 Cu 첨가강의 산화 메커니즘을 그림 7에 간략히 정리하였다. 즉, Ni 첨가강의 경우 Fe의 우선산화와 930 °C의 고온 영역대에서 Fe-Ni의 전율고용 특성에 따라 계면에 Ni 농화층을 형성하고 Ni 농화에 따른 Fe의 활동도 감소에 기인하여 내부산화물을 형성하며, 산소의 침투에 따른 부가적인 산화가 진행되며, 표면의 산화 scale과 내부산화물이 연결되어 보다 불균일한 계면형성을 초래한다. 반면, Cu 첨가강의 경우, Fe 내 Cu의 고용도가 극히 낮아, 일부 metallic Cu로의 석출이 이루어지고 내부산화에 대한 정도는 크게 고려되지 않으며 산소의 침투에 따른 부가적인 산화의 진행으로 scale 내부로 석출된 Cu의 잠식이 일어나며 scale 층 내부에서 Fe 자리에 일부 Cu가 치환되어 존재하는 형태를 가진다.
3.3. 선형 분극 거동 분석시편에 대한 침지시간 별 선형 분극 저항 실험 결과를 그림 8에 나타내었다. 우선, 침지 시간이 증가함에 따라 각 시편의 부식 전위가 점차 감소하였다. 아울러, Ni 첨가강의 경우 Cu 첨가강과 달리, 합금성분 증가에 따라 측정된 부식 전위 값이 상승함을 알 수 있다. 이와 같은 부식 전위 값 상승은 Ni 첨가에 따라 표면에 형성되어 있는 scale의 두께 증가에 따른 결과로 판단된다. 부식 전위의 이동은 표면의 양극반응과 음극반응의 상대적 조합으로 결정될 수 있으며, 부식 전위 값의 상승이 곧 부식 전류 값의 감소 및 높은 부식 저항성을 보증하지 않는다. 따라서 양극용해반응 (Fe → Fe2+ + 2e-) 및 음극환원반응 (O2 + 2H2O + 2e- → 4OH-)의 상대적 변화를 명확히 관찰할 필요가 있으며, Cu 첨가강의 경우 합금량 증가에 따라 철의 양극용해반응은 다소 증가하지만 산소환원반응은 크게 감소하여 부식 전위 값이 하강하는 거동이 관찰되나, Ni 첨가강의 경우 반대의 결과가 도출됨을 확인할 수 있다. 앞서 논의한 산화 메커니즘과 결부시켜 그 원인을 추론한다면, 우선 Ni 첨가강의 경우, Fe-Ni의 전율고용 특성에 기인하여 산화 후 scale/steel 계면에 형성되어 잔존하고 있던 Ni 농화층의 존재로 인해, Fe의 양극용해반응이 제어될 수 있는 가능성이 존재한다. 즉, Fe의 양극용해반응의 발생위치가 결국 scale/steel 계면의 직 하단부 steel 영역이므로, 계면에 일부 잔존하는 Ni 농화층은 양극용해반응을 일부 감소시키는데 기여할 수 있을 것으로 판단된다. 반면, Cu 첨가강의 경우 앞서 논의한 바와 같이, metallic의 형태로 석출된 Cu는 산화 후 scale층으로 잠식되어 scale 층을 형성하고 있는 Fe3O4 내 Fe 자리에 일부 치환되어, Fe2CuO4 형성하는 것으로 분석되었다. 즉, 양극용해반응이 일어나는 계면부의 steel에는 Fe의 용해를 억제시킬 수 있는 Cu 농화층이 존재하지 않으며 일부 metallic Cu만이 석출되어 있는 경우를 예상할 수 있다. 양극용해반응과 달리, scale/steel 계면 직 하단부 steel 영역뿐 아니라, 전도성을 가지는 scale층 자체에서도 음극환원반응이 발생할 수 있는 특성 [38]을 고려할 때, scale 층의 전기전도성은 음극환원반응을 제어하는 중요한 요인이 될 수 있다. Cu 첨가강의 경우 scale 층 내부에 Fe3O4 대비 전도성이 현저히 낮아 일종의 부도체로 간주 [38] 되는 Fe2CuO4의 형성에 기인해 산소환원반응의 감소된 정도가 높은 것으로 판단된다.
부식 저항성에 대한 정량적 분석 값 도출을 위해 24 시간 동안 침지 후 실험 값을 Wagner-Traud 식 (3)과 Stern-Geary 식 (4)을 이용하여 curve fitting하여 표 3에 결과값을 도출하였으며, 대표적으로 #1 시편에 대한 curve fitting 결과를 그림 9에 나타내었다. 즉, 실험치와 이론치의 차이를 최소화시키는 방식으로 수행된 curve fitting의 신뢰도가 높음을 예상할 수 있다. 표 3의 결과를 바탕으로, Ni 및 Cu 첨가강에 있어 첨가된 합금함량 및 침지시간이 증가할수록 내식성이 전반적으로 향상됨을 알 수 있다. 강종 별 비교에 있어서는 Cu 첨가강이 Ni 첨가강 대비 침지시간 및 합금함량 증가에 따른 내식성 향상 효과가 평균적으로 높게 나타나지만, 일반화하여 쉽게 단정짓기 힘들 정도의 차이라 판단된다. 다만, 본 소재가 자동차 하부 샤시용 부품으로서 다양한 부식환경에 노출될 가능성뿐만 아니라, 일정한 또는 반복적 응력이 함께 인가될 수 있는 상황을 배제할 수 없기 때문에, 응력부식균열에 대한 민감도 또한 추가로 고려되어야 한다. 특히 Ni 첨가강의 경우 scale/steel의 불균일한 계면특성으로 인해 응력부식균열에 대한 특성이 보다 열위할 것으로 예측되는 바, 향후 이에 대한 추가연구가 필요할 것으로 사료된다.
4. 결 론본 연구에서는 자동차 차체 및 샤시용 부품 소재로 적용이 고려되고 있는 마르텐사이트계 철강소재를 대상으로 하여, 소재 내 첨가된 합금성분 (Ni 및 Cu)이 고온 열처리 과정 중 산화되어 표면에 형성되는 scale의 형성 거동과, 이로 인한 저온 수용액 환경 내 전기화학적 부식 특성에 미치는 영향에 대해 연구를 수행하였다. 본 연구결과는 다음과 같이 요약된다.
강 내 첨가된 합금성분 함량에 비례하여 산화 scale의 두께가 증가하는 경향을 보였는데, Ni 첨가강은 동일 함량의 Cu 첨가강 대비, 고온 열처리 과정을 통한 산화 속도가 높았고, 일부 scale은 steel의 결정립계로 침투하여 scale/steel 계면의 평탄도가 현저히 낮았다. 이는 고온조건에서 Fe-Ni의 전율고용 특성과 산화초기 scale/steel 계면에 형성된 Ni 농화층의 존재로 인해 내부산화물이 형성되며 결국 불균일한 scale 침투로 귀결된 것으로 판단된다. 반면 Cu 첨가강의 경우 표면에 석출된 metallic Cu가 산화층 내부로 잠식되며, 이후 산화층 내부 Fe 자리에 일부 치환된 형태로 존재하는 것으로 나타났다.
선형 분극 실험 결과, Cu 첨가강의 경우 합금량 증가에 따라 철의 양극용해반응은 다소 증가하지만 산소환원반응은 크게 감소하여 부식 전위 값이 하강하는 거동이 관찰되나, Ni 첨가강의 경우 반대의 결과가 도출되었다. 즉, Ni 첨가강의 경우, 계면에 잔존하는 Ni 농화층의 존재로 인해, Fe의 양극용해반응이 제어될 수 있는 가능성이 존재하며, Cu 첨가강의 경우, scale 층 내부에 전도성이 현저히 낮은 Fe2CuO4의 형성에 기인해 산소환원반응의 감소된 정도가 높은 것으로 판단된다.
강 내 첨가된 합금 (Ni 및 Cu)함량 및 침지시간이 증가할수록 내식성이 전반적으로 향상되었는데, 강종 별 비교에 있어서 Cu 첨가강이 Ni 첨가강 대비 침지시간 및 합금함량 증가에 따른 내식성 향상 효과가 평균적으로 높게 나타나지만, 확연한 차이로 단정짓기는 힘들다. 응력부식균열 저항성 평가가 결부된 보다 장기 data의 확보가 필요할 것이다.
AcknowledgmentsThis research was supported in part by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (grant No. 2016R1D1A3B03930523) and the Korea government (MSIT) (No. 2019R1C1C1005007). Also, this work partly funded and conducted under the Competency Development Program for Industry Specialists of the Korean Ministry of Trade, Industry and Energy (MOTIE), operated by Korea Institute for Advancement of Technology (KIAT) (No. P0002019, HRD Program for High Value-Added Metallic Material Expert).
Fig. 2.Cross-sectional observations of (a) #1, (b) #2, (c) #3, (d) #4, (e) #5, and (f) #6 specimens, after normalizing conducted at 930 °C for 7 min. 
Fig. 3.Cross sectional images of oxidized #3 specimen observed by (a) OM, and (b) FE-SEM after nitric acid etching. 
Fig. 5.SEM images showing the scale/steel interface of oxidized (a) #3 specimen and (b) # 6 specimen. 
Fig. 7.Schematic diagram of high temperature oxidation of (a) Ni-bearing steel and (b) Cu-bearing steel. 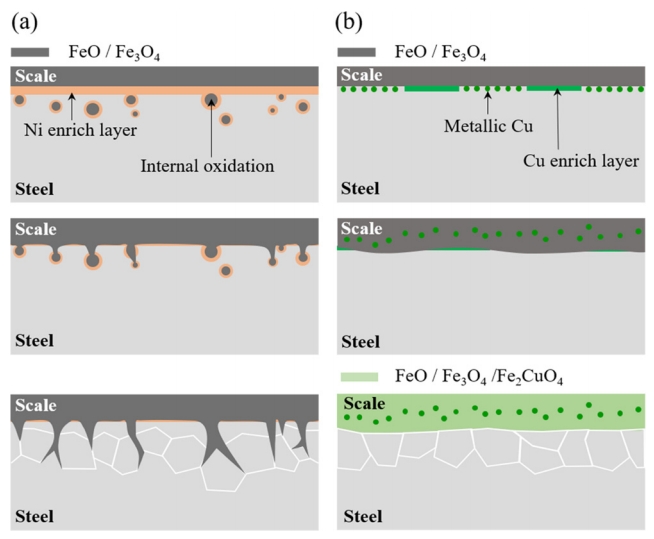
Fig. 8.Linear polarization resistance curves of pre-oxidized specimens, measured at (a) 0 h, (b) 3 h, (c) 6 h, and (d) 24 h immersion in 3.5% NaCl solution. 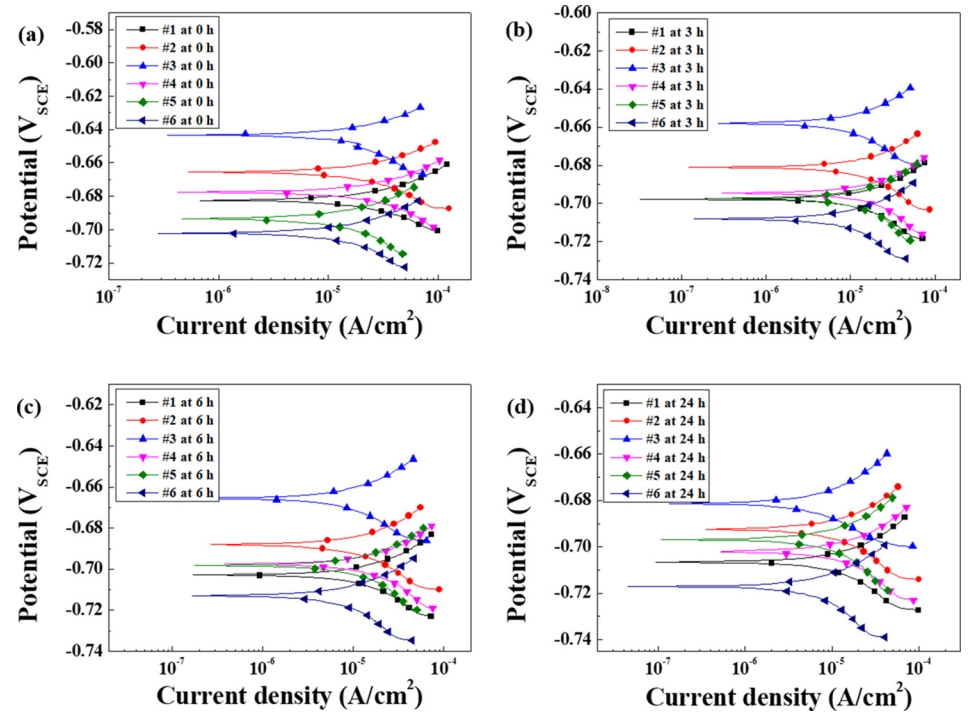
Fig. 9.Curve-fitting to linear polarization resistance curve of #1 specimen, measured at 6 h immersion in 3.5% NaCl solution. 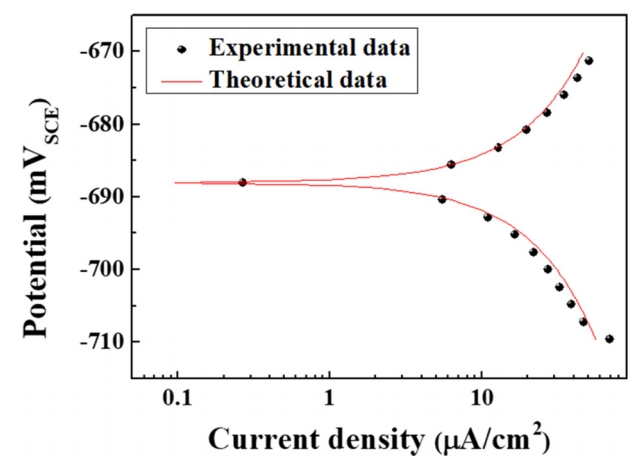
Table 1.Chemical composition of the tested steels (wt%). Table 2.Oxidation rate constant values determined by fitting to oxidation (weight gain) plots.
Table 3.Corrosion current density and corrosion rate obtained by curve-fitting to LPR curves of tested steels. REFERENCES2. S. L. Gibbons, R. A. Abrahams, M. W. Vaughan, R. E. Barber, R. C. Harris, and R. Arroyave, Mater. Sci. Eng. A. 725, 57 (2018).
12. Y. M. Hong and H. S. Kim, J. Corros. Soc. Kor. 27, 111 (1998).
14. H. Ohashi, T. Adachi, and K. Maekita, Tetsu-to-Hagane. 66, S1309 (1980).
23. H. Gotlind, F. Liu, J. E. Svensson, M. Halvarsson, and L. G. Johasson, Oxid Met. 67, 251 (2007).
25. T. Maeda, S. Ukai, S. Hayashi, N. Oono, Y. Shizukawa, and K. Sakamoto, J. Nuclear Mater. 516, 317 (2019).
27. W. J. Nowak, D. Naumenko, A. Jalowicka, D. J. Yong, V. Nischwitz, and W. J. Quadakkers, Mater. Corros. 68, 171 (2017).
28. G. H. Meier, K. Jung, N. Mu, N. M. Yanar, F. S. Pettit, J. P. Abellan, T. Olszewski, L. N. Hierro, W. J. Quadakkers, and G. R. Holcomb, Oxid. Met. 74, 319 (2010).
29. L. Suarez, R. Coto, X. Vanden Eynde, M. Lamberigts, and Y. Houbaert, Def. Diffus. Forum. 258, 158 (2006).
35. D. B. Lee, J. O. Jung, S. Y. Park, G. C. Cho, X. Xiao, and M. J. Kim, J. Korean Inst. Surf. Eng. 51, 104 (2018).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||